第二章 原子结构与原子光谱
 知识点二:量子数与波函数
知识点二:量子数与波函数
1.量子数的物理意义
(1)主量子数n
(i). 确定能量 对单电子原子而言,主量子数n决定体系能量的高低
![]() (eV) (2.2-1)
(eV) (2.2-1)
n的取值为1,2,3……,当n无穷大时,体系的能量趋近于0,这样的物理模型可以被当做参考体系的零点。
能级差随主量子数n的变化关系:
![]()
所以,随着主量子数n的增大,能级差是逐渐减小的。
(ii)确定简并度 具有相同能量的不同状态的个数称为简并度。
对于单电子体系,只要n值相同,就具有相同的能量,但可有不同的l和m值,它们代表着不同的状态,这些状态互称为简并态。简并度与量子数的关系可表示为:
![]()
(iii)确定波函数的节面个数 波函数等于零的点所构成的平面或曲面称为节面。
径节面数 = n- l -1;角节面数 = l;总节面数 = 径节面数+角节面数 = n-1。
(2)角量子数 ![]()
将角动量平方算符作用于![]() 上可得下式:
上可得下式:
![]()
![]() 的本征值和角动量大小分别为
的本征值和角动量大小分别为
![]()
![]() (2.2-2)
(2.2-2)
可见,l决定电子的轨道角动量的大小,因此,称其为角量子数。另外,原子的角动量和其磁矩(![]() )有关,其关系为:
)有关,其关系为:
![]()
![]() (2.2-3)
(2.2-3)
其中![]() 为Bohr磁子,
为Bohr磁子,![]() 。
。
(3)磁量子数m
在解F方程时引入了磁量子数m,物理意义是:决定电子轨道角动量在磁场方向上的分量Mz,也决定轨道磁矩在磁场方向上的分量![]() 。
。
将角动量在z轴上的分量算符作用于![]() 上可得如下式:
上可得如下式:
![]()
所以
![]() (2.2-4)
(2.2-4)
同样,轨道磁矩可以求出,得到
![]()
角动量在磁场方向分量的量子化,已通过Zeeman效应得到证实。
(4)自旋量子数s
电子除了有轨道运动外,还有自旋运动,自旋量子数为s=![]() ,自旋磁量子数为
,自旋磁量子数为![]() 。
。
自旋运动角动量的大小为:
![]() (2.2-5)
(2.2-5)
自旋运动角动量在z轴的投影:
![]() (2.2-6)
(2.2-6)
同时伴随自旋运动又有自旋磁矩,其大小
![]()
它在z轴的分量为:
![]()
其中,ge为电子的自旋因子,![]() ,由于电子磁矩方向与角动量方向相反,故加负号。
,由于电子磁矩方向与角动量方向相反,故加负号。
(5)总角量子数j
因为电子的轨道运动与自旋运动的角动量都是矢量,电子的总角动量Mj就是两者的矢量和,Mj= M + Ms,它的大小由总角动量量子数j决定。若轨道角动量量子数为l,自旋量子数为s,则总角动量量子数
![]() (2.2-7)
(2.2-7)
(2.2-7)适合于任意两个角动量的耦合。总角动量的平方为
![]() (2.2-8)
(2.2-8)
角动量大小为
![]()
对于任何一个角量子数为L的角动量,这个角动量![]() 的平方值总是
的平方值总是
![]() (2.2-9)
(2.2-9)
其大小为
![]() (2.2-10)
(2.2-10)
反过来,知道了角动量大小,可推出角量子数。
(6)总磁量子数mj
对于任何一个角量子数为L的角动量,其沿某坐标轴的投影(若存在磁场就是磁场方向,通常取作z轴)为
![]()
电子的总角动量Mj沿z轴的分量Mjz为
![]()
因为轨道角量子数l是整数,s=1/2,所以对于单电子体系j是半整数。
![]()
这样,描述单电子原子状态的量子数有上述6个,但其独立的量子数只有4个,可采用量子数(n,![]() ,m,ms)或(n,
,m,ms)或(n,![]() ,j,mj)来描述。
,j,mj)来描述。
2 波函数和力学量
Ψnlm(r,θ,f)描述单电子原子的运动状态,还是能量算符![]() 、角动量平方算符
、角动量平方算符![]() 、角动量在z轴方向的分量
、角动量在z轴方向的分量![]() 共同的本征函数:
共同的本征函数:
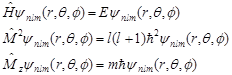
若单电子原子处ψnlm(r,θ,f)描述的本征态中,由以上本征方程可以求出力学量的本征值:
![]() ,
,![]() ,
,![]()
但对于非本征态,如氢原子核外电子处于![]() 轨道时,对应的波函数是实函数由
轨道时,对应的波函数是实函数由![]() 与
与![]() 组合而成,也就是由这两个态叠加而得,即
组合而成,也就是由这两个态叠加而得,即![]() ,
,![]() 不是算符
不是算符![]() 的本征函数,因此没有确定的
的本征函数,因此没有确定的![]() 值,只有平均值:
值,只有平均值:![]() 。
。
对任意力学量![]() ,在波函数Ψnlm(r,θ,f)描述的状态下,其平均值(期望值)
,在波函数Ψnlm(r,θ,f)描述的状态下,其平均值(期望值)
![]()
3 电子云的图形表示
(1)y-r 和y2-r图
![]() 的分布具有球对称性,核外等距离r处的球面上各点的y值相同,几率密度y2的数值也相同。
的分布具有球对称性,核外等距离r处的球面上各点的y值相同,几率密度y2的数值也相同。
H原子(Z=1)的1s和2s态波函数采用原子单位可简化为:
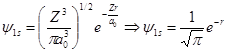
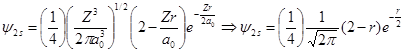
对于1s态:核附近电子出现的几率密度最大,随r增大稳定地下降。
对于2s态:在r<2a0时,分布情况与1s态相似;在r=2a0时,y=0,出现一球形节面(节面数=n-1);在r>2a0时,y为负值,到r=4a0时,负值绝对值达最大;r>4a0后,y渐近于0。
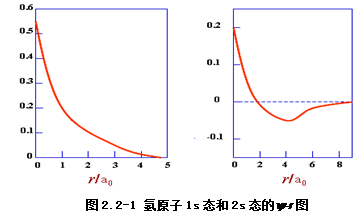
1s态无节面;2s态有一个节面,电子出现在节面内的几率为5.4%,节面外为94.6%;3s态有两个节面,第一节面内电子出现几率为1.5%,两节面间占9.5%,第二节面外占89.0%。
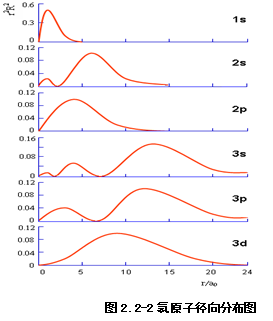
(2)径向分布图
其物理意义:Ddr表示在半径r→r+dr两球壳层内找到电子出现的几率,它反映了电子云的分布随半径r的变化情况。将![]() dt在q和f的全部区域积分,即表示离核为r,厚度为dr的球壳内电子出现的概率。
dt在q和f的全部区域积分,即表示离核为r,厚度为dr的球壳内电子出现的概率。
图2.2-2为H原子的径向分布图。在径向分布图中,除原点外,![]() 的面为径向节面。
的面为径向节面。
由图2.2-2可以看出:
(1)每一个n和![]() 确定的状态,有n-
确定的状态,有n-![]() 个极大值和n-
个极大值和n-![]() -1个径向节面。
-1个径向节面。
(2)n相同时:![]() 越大,主峰离核越近;
越大,主峰离核越近;![]() 越小,峰数越多,最内层的峰离核越近;
越小,峰数越多,最内层的峰离核越近;![]() 相同时:n越大,主峰离核越远;说明n小的轨道靠内层,能量低。
相同时:n越大,主峰离核越远;说明n小的轨道靠内层,能量低。
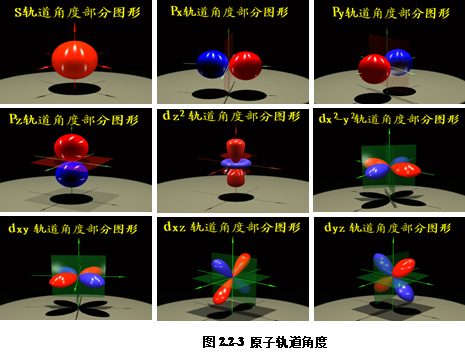
(3)角度分布![]()
从坐标原点引方向为![]() 、长度为
、长度为![]() 的射线,所有这些射线的端点在空间所组成的曲面,称为原子轨道
的射线,所有这些射线的端点在空间所组成的曲面,称为原子轨道![]() 的角度分布图。由Y=0产生的节面称为角节面。
的角度分布图。由Y=0产生的节面称为角节面。
![]() =0°对应于z轴的正方向,
=0°对应于z轴的正方向,![]() =180°对应于z轴的负方向。
=180°对应于z轴的负方向。
按![]() cos
cos![]() 计算出不同
计算出不同![]() 值时的Y值,因为
值时的Y值,因为![]() 只含
只含![]() 而不含有
而不含有![]() ,图2.2-3给出不同原子轨道的角度分布图。
,图2.2-3给出不同原子轨道的角度分布图。
(4)空间分布
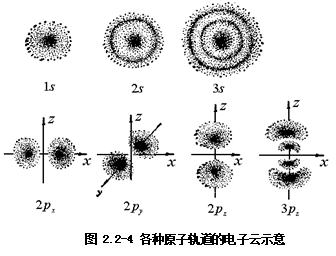
空间分布图有多种表达形式,如电子云图、原子轨道轮廓图、等值线图以及界面图、网格立体图等。下面只简单介绍电子云图和原子轨道轮廓图。
(i)电子云图。 将![]() 的大小用小黑点在空间分布的疏密程度来表示的图形称为电子云图,见图2.2-4。
的大小用小黑点在空间分布的疏密程度来表示的图形称为电子云图,见图2.2-4。
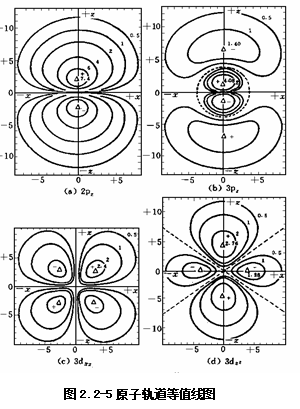
(ii)原子轨道等值线图 y(原子轨道)随r,q,f改变,不易画出三维图,通常可画截面图,把面上各点的r,q,f值代入y中,根据y值的正负和大小画出等值线,即为原子轨道等值线图。
(iii)原子轨道轮廓图。
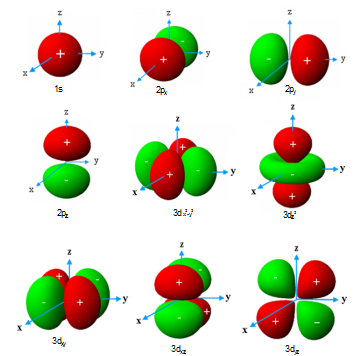
图2.2-6 原子轨道轮廓图(各类轨道标度不同)
把y的大小轮廓和正负在直角坐标系中表达出来,以反映原子轨道空间分布的立体图形叫做原子轨道轮廓图,或简称原子轨道图,如图2.2-6所示。原子轨道图为了解成键时轨道重叠情况提供了明显的图像。
