第二章 原子结构与原子光谱
 知识点三:多电子原子结构与原子轨道
知识点三:多电子原子结构与原子轨道
1.多电子原子的Schrödinger方程
对于原子序数为Z,含n个电子的原子,其Schrödinger方程为:
(![]() )
)![]() =En
=En![]() (2.3-1)
(2.3-1)
这里由于![]() 的存在,使得无法将各个电子相互分离,而忽略电子之间的相互作用引起的误差又是很大的。这时,可以把多电子原子中的每个电子看作是在原子核和其余n-1个电子共同形成的平均势场中运动,用单电子函数来描述其运动状态,称为单电子近似。这种用来描述原子中单个电子运动状态的波函数称为原子轨道,单电子的Schrödinger方程为:
的存在,使得无法将各个电子相互分离,而忽略电子之间的相互作用引起的误差又是很大的。这时,可以把多电子原子中的每个电子看作是在原子核和其余n-1个电子共同形成的平均势场中运动,用单电子函数来描述其运动状态,称为单电子近似。这种用来描述原子中单个电子运动状态的波函数称为原子轨道,单电子的Schrödinger方程为:
![]()
式中yi是所考虑电子的坐标函数,V是该电子与其余n-1个电子之间的排斥能。V除了和所考虑的电子坐标有关,还和其余n-1个电子的坐标有关。作为一种平均情况,可以认为第i个电子是在其余n-1个电子所形成的电子云的云雾中运动,势能V与其它n-1个电子的运动状态有关,当其余n-1个电子状态一定时,V就只是所考虑的电子的坐标的函数了。但这时V仍然是电子i的三个坐标r、q、f的函数,不能进一步分离变量,方程仍然难以求解。
2.中心势场近似
将原子中其他n-1个电子对所考虑电子i的排斥作用看成是球形对称的、只与径向有关的力场,称为中心势场近似。在中心势场近似的情况下,第i个电子受其余电子的排斥作用看成相当于si个电子在原子中心与之相互排斥。第i个电子的势能函数可写成:
![]() (2.3-2)
(2.3-2)
此式在形式上和单电子原子的势能函数相似,Z*称为有效核电荷。
因此,中心力场模型下多电子原子中第i个电子在原子单位下的Schrödinger方程为:
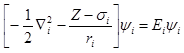 (2.3-3)
(2.3-3)
此方程中的坐标ri不再是位置矢量,而只代表径向坐标,不再涉及角向坐标。方程中描述原子中单电子运动的空间波函数为原子轨道。
3.原子轨道能量计算
在单电子近似和中心力场近似的基础上,解多电子原子的Schrödinger方程还需要知道电子间的势能V,考虑到用变分法处理氦原子的结果,每个电子与另一电子的相互作用可以看作起到了核电荷屏蔽的作用,表现为好像是抵消掉了部分核电荷,若用表示第i个电子对第j个电子的核电荷屏蔽,那么对第j个电子总的屏蔽系数为:
![]()
原子核对第j个电子有效核电荷为:![]() ,则电子所处的轨道能量Ei 公式为:
,则电子所处的轨道能量Ei 公式为:
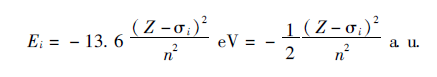
角量子数为1, 2, 3, ...的s, p, d...电子对同一电子的屏蔽作用各不相同,多电子原子体系的轨道能Ei 由主量子数和角量子数共同确定。对单电子原子来说,ns和np是简并的,但对多电子原子来说这种简并解除了。
