第三章 双原子分子结构与性质
 知识点二:分子轨道理论
知识点二:分子轨道理论
1.分子中的单电子波函数—MO
在定核近似下,若分子体系含有m个核及n个电子,哈密顿算符为:
![]() (4-1.21)
(4-1.21)
与多电子原子的情况一样,最常用的解决办法采用单电子近似(轨道近似)。分子体系中单电子有效哈密顿算符可写成:
![]() (4-1.22)
(4-1.22)
式中 ![]() ,此时分子体系的单电子薛定谔方程式为:
,此时分子体系的单电子薛定谔方程式为:
![]() (4-1.23)
(4-1.23)
式中单电子波函数yi为分子轨道波函数,相应的本征值Ei为分子轨道能。
对于给定分子的任何一个MO都可以由有关的AO线性组合而成,即:
![]() (4-1.24)
(4-1.24)
称![]() 为yj的基函数。
为yj的基函数。
2.满足有效组合成分子轨道的原子轨道的条件——LCAO —MO三原则
以双原子分子AB为例。
若![]() 为A原子的轨道,
为A原子的轨道,![]() 为B原子的轨道,它们的能量和类型均不同。将两者线性组合:
为B原子的轨道,它们的能量和类型均不同。将两者线性组合:
![]() (4-1.25)
(4-1.25)
根据前一个知识点![]() 和
和![]() 的定义,
的定义,![]()
![]() ,
,![]() ,此处
,此处![]() 和
和![]() 取为轨道
取为轨道![]() 和
和![]() 的能量。
的能量。
应用变分法处理,并略去![]() 项,所得到的久期方程是:
项,所得到的久期方程是:
![]() (4-1.26)
(4-1.26)
解相应的久期方程:

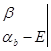 = 0 (4-1.27)
= 0 (4-1.27)
能量为(此时假定![]() ):
):
![]()
设 ![]() (4-1.28)
(4-1.28)
则 ![]() ,
,![]() (4-1.29)
(4-1.29)
因![]() ,h应为正值,可做出能级图4-1.6。
,h应为正值,可做出能级图4-1.6。
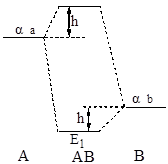
图4-1.6 分子AB的MO能级示意图
当电子排入E1能级以形成双电子键时,则分子AB的离解能可表示为:
![]() (4-1.30)
(4-1.30)
显然, 成键效果决定于(![]() )和
)和![]() 的数值。再将
的数值。再将![]() 和
和![]() 分别代入相应的久期方程(4-1.26)式:
分别代入相应的久期方程(4-1.26)式:
![]() (4-1.31a)
(4-1.31a)
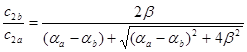 (4-1.31b)
(4-1.31b)
与![]() 和
和![]() 相对应的两个分子轨道为:
相对应的两个分子轨道为:
![]() (4-1.32a)
(4-1.32a)
![]() (4-1.32b)
(4-1.32b)
从4-1.28, 4-1.29, 以及4-1.31式可见,若![]() 则h=0, 两个原子轨道
则h=0, 两个原子轨道![]() 、
、![]() 不能有效地组合成分子轨道。
不能有效地组合成分子轨道。
那麽![]() 、
、![]() 间要满足什么条件时
间要满足什么条件时![]() ?
?
- 对称性匹配原则
以![]() 、
、![]() 轨道组合成分子轨道(图4-1.7a)以及
轨道组合成分子轨道(图4-1.7a)以及![]() 而
而![]() 轨道组合成分子轨道(图4-1.7b)时的情况为例。
轨道组合成分子轨道(图4-1.7b)时的情况为例。
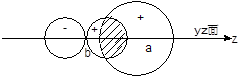
(a) (b)
图4-1.7 LCAO-MO对称性匹配的条件
显然图4-1.7b可以组合成分子轨道,这就是LCAO —MO中的对称性匹配原则。
(b) 最大重叠原则
现在讨论在![]() 时,使LCAO—MO产生最佳效果的条件。
时,使LCAO—MO产生最佳效果的条件。
从4-1.28和4-1.29式可知,在![]() 和
和![]() 确定的条件下,
确定的条件下,![]() 值越大,意味着两个轨道组合效果越好;而根据上一个知识点中的-1.19式可知
值越大,意味着两个轨道组合效果越好;而根据上一个知识点中的-1.19式可知
交换积分β
![]()
即要求![]() 应尽可能的大,这就是最大重叠原则。
应尽可能的大,这就是最大重叠原则。
如何能使![]() 、
、![]() 间产生最大重叠呢?这除了与两原子核间距离有关外,还将与接近的方向有关。
间产生最大重叠呢?这除了与两原子核间距离有关外,还将与接近的方向有关。
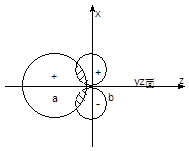
图4-1.8给出了在相同核间距时![]() 和
和![]() =
=![]() 沿不同方向重叠的情况。该图表明,当
沿不同方向重叠的情况。该图表明,当![]() 沿
沿![]() 的极值方向重叠时方可有最大重叠效果,这决定了共价键具有方向性。
的极值方向重叠时方可有最大重叠效果,这决定了共价键具有方向性。
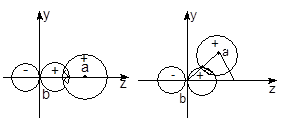
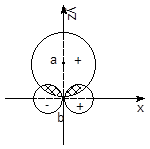
(a) (b) (c)
图4-1.8 φs和φpz沿不同方向重叠对Sab的影响
[ Sab(a)> Sab(b)> Sab(c)= 0 ]
(c) 能量相近原则
进一步讨论![]() 和
和![]() 的取值对
的取值对![]() 、
、![]() 组合效果的影响。
组合效果的影响。
因为![]()
表明,当![]() >>
>>![]() 即
即![]() 和
和![]() 间能量差很大时,将有
间能量差很大时,将有![]() -
-![]() >>2
>>2![]() ,h
,h![]() 0。
0。
此时E1![]()
![]() 、E2
、E2![]()
![]() ,说明线性组合后的MO能量还原为AO能量,即ψ1
,说明线性组合后的MO能量还原为AO能量,即ψ1![]()
![]() 、ψ2
、ψ2![]()
![]() 。而当
。而当![]() =
=![]() 时,可得h=
时,可得h=![]() 、C1a= C1b和C1a= -C1b,能有效组合成分子轨道,类似于H2+中的结果。
、C1a= C1b和C1a= -C1b,能有效组合成分子轨道,类似于H2+中的结果。
