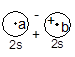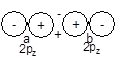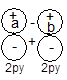第三章 双原子分子结构与性质
 知识点三:同核和异核双原子分子的结构
知识点三:同核和异核双原子分子的结构
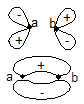
1.MO的类型和符号 两个对称性相一致的AO所组合成的MO具有某种对称性,因而MO可按其对称性及特定的节面加以分类。通常分子轨道分成σ、π、δ三种类型,图4-1.10给出了同核双原子分子各种不同分子轨道的示意图(键轴为z轴)。
原子轨道 |
分子轨道 |
键型 |
轨道符号 |
|
|
反键 成键 |
σ*2s(2σu) σ2s(2σg) |
|
|
反键 成键 |
σ*2pz(3σu) σ2pz(3σg) |
|
|
反键
成键 |
π*2p(1πg)
π2p(1πu) |
图4-1.10 同核双原子分子MO轨道图形
(i)σ分子轨道:当MO是由s-s、pz-pz组合而成时,具有键轴轴对称性,称这类分子轨道为σ轨道。记为σns、σnpz。按中心对称性及有无节面又可分为成键的σ轨道及反键的σ轨道。例如![]() 2s+
2s+![]() 2s所得的σ轨道是中心对称的,是成键的;该轨道无节面,能量低,也记为σ2s。由
2s所得的σ轨道是中心对称的,是成键的;该轨道无节面,能量低,也记为σ2s。由![]() 2s-
2s-![]() 2s所得的σ轨道是中心反对称的,是反键的;该轨道有节面,能量高,记为σ*2s。
2s所得的σ轨道是中心反对称的,是反键的;该轨道有节面,能量高,记为σ*2s。
(ii)π分子轨道:当MO是由py-py、px-px组合而成时,因为py和px分别对包括键轴的xz面和yz面的反映是反对称的,所以它们按照对称性相一致的原则组合所得的MO具有类似的对称性,xz面及yz面恰是这两种MO的节面。若MO有含键轴的对称面为πMO。若π轨道对键轴中心的反演是反对称的和不含垂直键轴的节面,能量低,是成键的π轨道,记为π2p;若对键轴中心的反演是对称的和有一个垂直平分键轴的节面,能量高,是反键轨道,记为π*2p。
对于同核双原子分子,除了上面介绍的MO符号外,还有另一套表示符号,参看表4-1.1。
表4-1.1 分子轨道符号对应关系
同核双原子分子 |
σ2s |
σ*2s |
π2py π2px |
σ2pz |
π*2py π*2px |
σ*2pz |
2σg |
2σu |
1πu |
3σg |
1πg |
3σu |
|
异核双原子分子 |
3σ |
4σ |
1π |
5σ |
2π |
6σ |
2.能级顺序 对于双原子分子,可将各种分子轨道按照能量不同由低到高排成顺序,则组成该分子的轨道能级序。第二周期元素的同核双原子分子,由Li2到N2的分子轨道能级序为
σ1s<σ*1s<σ2s<σ*2s<π2py=π2px<σ2pz<π*2py=π*2px<σ*2pz
而且,能够依照分子轨道能级顺序画出分子轨道能级图。
以上给出的分子轨道的符号和能级顺序只适用于同核双原子分子。对于异核双原子分子来说,因为组成分子轨道的基函数属于类型不同、能量不同的原子轨道,所以,分子轨道已经失去了中心对称性,只分别按照σ和π轨道类型,冠上自然数字以表示能级高低的顺序,例如1σ、2σ、3σ,… 及1π,2π,…。
3.电子填充(构造)原则 遵照LCAO—MO的三条基本原则,原子轨道将组合成分子轨道,它们有着一定的能级顺序,分子中的所有电子就要按某种规则去占据分子轨道。在分子中,电子填充分子轨道的规则和原子中电子填充规则相同,即能量最低原则、保里原理和洪特规则。
若电子排入成键轨道如1sg 轨道,将使核间电子云密度大于对应的原子体系,使分子稳定,称为成键电子;若电子排入反键轨道如1s u 轨道,将使核间电子云密度小于对应的原子体系,使分子体系不稳定,称为反键电子。定义双原子分子的键级为:
键级=![]() (4-2.2)
(4-2.2)
式中nb是成键电子总数,na反键电子总数,故nb - na是净成键电子数。所以键级描述了原子间的成键程度或化学键的强弱。
4.同核双原子分子
(1)第一周期有H和He二种元素,只有1s轨道排布了电子。根据上节对H2+的讨论,同核分子中两原子1s轨道可有效组合成成键的1sg 和反键的1s u 两个分子轨道, 并且E(1sg )<E(1s u )。
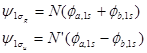 (4-2.1)
(4-2.1)
这样可得H2+、H2、He2+和He2分子的基态组态为:
H2+ :1sg1
H2 :1s g 2
He2+ :1s g21su1
He2+ :1s g 21s u 2
这样,H2+、H2、He2+和He2分子的键级分别为0.5、1、0.5和0,它们稳定性的次序为:
H2>H2+~He2+>He2
电子排入成键轨道给分子带来的稳定化能要小于电子排入反键轨道给分子带来的不稳定化能,因此键级为零的He2分子,基态不存在,仅其激发态(如组态为1sg 21s u 12sg 1,寿命也极其短暂)在光谱中被观察到。
对于H2+和He2+分子体系,各有一个未成对电子,自旋不配对,在磁场中呈顺磁性;而H2和He2分子,无未成对电子,在磁场中则呈反磁性。
(2)对于第二周期各元素,有内层的1s轨道和2s、2p外层轨道。按照LCAO-MO三原则,在满足对称性条件下,键合原子间只有能级相近的AO才能有效组合成MO。
表4-2.1给出第一、二周期各元素AO的能级,可知第二周期元素内层的1s轨道和外层的2s、2p轨道能级差极大,不可能有效组合。考虑到内层轨道的收缩效应,使两原子的1s轨道重迭极小,也不可能有效地组合成MO,在分子中基本保持原子轨道的特征。在分子轨道理论中,既可以用KK、也可以用1sg21su2来表示它们内层1s电子的组态。
表4-2.1 第一、二周期元素各原子轨道上电子的电离能(单位:eV)
元素符号 |
1s |
2s |
2p |
电子组态 |
H |
13.60 |
|
|
1s* |
He |
24.59 |
|
|
1s2 |
Li |
58 |
5.392 |
|
1s22s |
Be |
115 |
9.322 |
|
1s22s2 |
B |
192 |
12.93 |
8.298 |
1s22s22p |
C |
288 |
16.59 |
11.26 |
1s22s22p2 |
N |
403 |
20.33 |
14.53 |
1s22s22p3 |
O |
538 |
28.48 |
13.62 |
1s22s22p4 |
F |
694 |
37.85 |
17.42 |
1s22s22p5 |
*在某壳层或亚壳层上排布的电子数为1 时,1可省略。
对于第二周期元素外层轨道,2s和2p轨道间的能级差可分为两种情况:由B到N, 能级差相对较小,而O和F能级差相对较大。
这样若原子沿Z轴成键,两个O或F原子的2s或2pz轨道间将分别组合成2sg、2su和3sg、3su四个MO,而2px、、2py将分别组合成1pu(p2px 和p2py)和 1pg(p2px* 和p2py*)两组两重简并的p 型MO。由于形成s 型MO 时,O或F的2pz轨道是沿着极大值方向重叠的,组合比p 型MO更有效,使成键的3sg MO能级低于1pu,而反键的3su MO能级大于1pg。
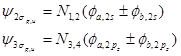
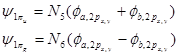 (4-2.3)
(4-2.3)
B到N的情况则不同,两个原子的2s 、2pz轨道能级相近且都满足键轴轴对称, 可共同有效地组合成2sg、2su、3sg和3su四个MO。
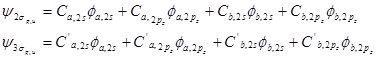 (4-2.4)
(4-2.4)
这样组合成的2sg、3su是强成键和强反键轨道,2su为弱反键轨道,而弱成键轨道3sg的能级高于1pu,如图4-2.1 所示。对于N2 分子,该MO 能级顺序已被光电子能谱的实验结果所证实(详见第五章有关内容)。
(a) (b)
图4-2.1 同核双原子分子MO能级图(a)B2~N2,(b)O2和F2
表4-2.2列出同核双原子分子基态的电子组态及相关性质。
正因为N2分子的电子组态为KK2sg22su21pu43sg2,键级等于3,加上氮大的电负性,化学键的键长比乙炔中碳-碳叁重键键长还短、键能还大(键能为945.33kJ/mol);另外从空间效应上看,电子云分布在分子外侧、化学活性大的1pu 电子能量上低于电子云分布在核间、化学呈惰性的3sg电子,两者的共同作用使N2分子不仅从能量看十分稳定、在化学反应中也呈现很强的惰性。由于该电子组态为闭壳层结构,无未成对电子,分子呈反磁性。
O2分子的电子组态为KK2sg22su23sg21pu41pg2。按照洪特规则,在两重简并的1pg轨道上的两个电子基态时应采用自旋平行方式排布,具有较明显的顺磁性,已被实验证实。由于O2分子有两个反键的未成对的1pg电子,键级为2,具有较强的化学活性。
F2分子的电子组态为KK2sg22su23sg21pu41pg4,键级为1。如前所述,电子排入成键轨道给分子带来的稳定化能要小于电子排入反键轨道给分子带来的不稳定化能,使F2分子的键能较小,为157kJ/mol;又因F的电负性很高,因此F2分子化学性质很活泼。
表4-2.2 同核双原子分子的基态组态和有关性质
分子 |
基态组态 |
键级 |
未成对电子数 |
键长(pm) |
离解能(eV) |
自旋多重度* |
H2+ |
1s g ** |
0.5 |
1 |
106 |
2.7928 |
2 |
H2 |
1s g 2 |
1 |
0 |
74 |
4.7477 |
1 |
He2+ |
1s g 21s u |
0.5 |
1 |
108 |
2.5 |
2 |
He2 |
1s g 21s u 2 |
0 |
0 |
288 |
0.001 |
1 |
Li2+ |
[He2]2sg |
0.5 |
1 |
314 |
1.29 |
2 |
Li2 |
[He2]2sg2 |
1 |
0 |
267.3 |
1.05 |
1 |
Be2+ |
[He2]2sg22su |
0.5 |
1 |
未定 |
未定 |
未定 |
Be2 |
[He2]2sg22su2 |
0 |
0 |
—— |
0.07 |
1 |
B2+ |
[Be2]1pu |
0.5 |
1 |
—— |
1.8 |
2 |
B2 |
[Be2]1pu2 |
1 |
2 |
158.9 |
~3 |
3或5 |
C2+ |
[Be2]1pu3 |
1.5 |
1 |
130.1 |
5.3 |
2 |
C2 |
[Be2]1pu4 |
2 |
0 |
124.25 |
6.36 |
1 |
N2+ |
[Be2]1pu43sg |
2.5 |
1 |
111.6 |
8.86 |
2 |
N2 |
[Be2]1pu43sg2 |
3 |
0 |
109.8 |
9.798 |
1 |
O2+ |
[Be2]3sg21pu41pg |
2.5 |
1 |
111.71 |
6.7796 |
2 |
O2 |
[Be2]3sg21pu41pg2 |
2 |
2 |
120.75 |
5.2132 |
3 |
F2+ |
[Be2]3sg21pu41pg3 |
1.5 |
1 |
132 |
3.39 |
2 |
F2 |
[Be2]3sg21pu41pg4 |
1 |
0 |
142 |
1.65 |
1 |
Ne2+ |
[Be2]3sg21pu41pg43sg |
0.5 |
1 |
170 |
~1.1 |
2 |
*自旋多重度=2S+1。
4.异核双原子分子
与同核双原子分子不同,异核双原子分子中两个原子的AO间不再是能量和对称性都一一对应相同的轨道,因此情况要复杂的多,需要具体情况具体分析。下面讨论几个有代表性的分子。
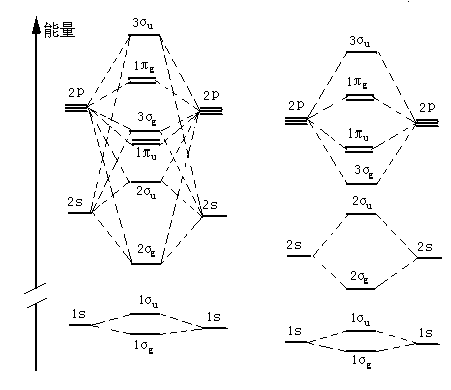
(1)LiH 分子 由表4-2.1可知, 金属Li 的1s 轨道能远低于2s 轨道和H 的1s 轨道能,不参与成键是非键轨道;由于对称性满足轴对称,能量最低,通常记为1s,也可记为K。由于Li 的2s 轨道能高于H 的1s 轨道能,由4-1.30 和4-1.31 式可知,在成键的2s 轨道中能量低的H 的1s 轨道线性组合系数大,而在反键的3s 轨道中能量高的Li 的2s 轨道线性组合系数大。
![]() (4-2.5)
(4-2.5)
LiH分子的基组态为:1s22s2, 两个非键电子,两个净成键电子,分子的键级为1,闭壳层结构为反磁性分子。电子排入2s 轨道,电子云集中在H原子周围,形成极性键。实验测出LiH 分子键长为159.5pm, 偶极矩由Li原子指向H原子为5.882德拜。
(2)HF分子 F是电负性极强的元素,它的2s、2p 轨道能都比H 的1s 轨道能低。当键轴为Z轴时,它的1s、2s、2px、、2py 成为分子的1s、2s 和1p 非键轨道,2pz 和H 的1s 轨道组合成成键的3s 轨道,基组态为:1s22s2 3s21p4,键级为1,闭壳层结构为反磁性分子。与LiH 不同的是在3s 轨道中F的2pz 轨道组合系数要明显大于H 的1s 轨道组合系数,故分子的极性是由H指向F。实验测出HF 分子键长为92pm, 偶极矩为1.82德拜,是一强极性分子。
比较HF和LiH分子的键长既可判断,虽然两个分子都是极性分子、键级为1,HF要比LiH分子稳定的多。
H LiH Li
图4-2.3 LiH 分子轨道能级、电子排布图
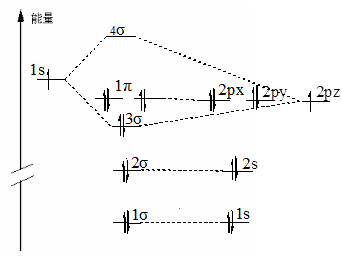
H HF F
图4-2.4 HF分子轨道能级、电子排布图
(3) CO分子 CO与N2分子的电子数目相同,C和O分别是第二周期Ⅳ和Ⅵ族元素、与N左右相邻,因此它们具有相似的电子结构。这被称为讨论双原子分子(离子)性质时的等电子原理。
N2:KK2sg22su21pu43sg2
CO: KK3s24s21p45s2
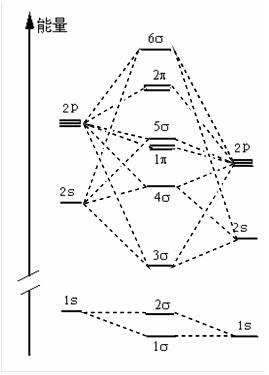
C CO O
图4-2.5 CO 分子MO 能级图
与N2分子一样,CO分子也具有5s电子能量高于1p 电子的叁重键的结构,在化学反应中呈现一定的惰性。
从表4-2.1 可以看到,C和O相应的原子轨道能量差别还是比较大的。计算表明,CO的1s 轨道实际就是O原子的1s轨道,2s 轨道就是C 原子的1s 轨道;而3s 轨道O原子的2s轨道成分多,是强成键轨道;4s 轨道O的2p 和C的2s轨道成分较多,是弱成键轨道;5s 轨道主要由C的2p和2s轨道构成,近非键轨道;进一步的分析指出,5s 电子的电子云相对集中在分子C原子的外侧,与N2 的3sg轨道的电子云对称分布区别明显(见图6-2.1)。这使得在与金属络合形成配合物时,CO用5s 轨道进行端基络合,而N2进行端基络合就比CO困难的多。 这是由CO为配体的羰基配合物大量稳定存在的主要原因。