第六章 配位化合物的结构与性质
 知识点二:CO 和N2配位化合物的结构与性质
知识点二:CO 和N2配位化合物的结构与性质
一、羰基配合物
绝大部分过渡金属都能与CO 分子形成稳定的羰基配合物,且配键的形成可使金属外层电子结构满足18电子规律。 如Cr(CO)6、Fe(CO)5、Ni(CO)4等。实验测定表明,CO以碳原子与金属相连,M-C-O 处于同一直线上,为端基络合。
CO 的电子组态为:KK3s24s21p45s22p0 。其中,弱成键的5s 轨道中碳的原子轨道贡献大,最大值方向沿O-C键指向分子中碳原子外側,可近似视为碳原子的孤对电子轨道,与M-L键轴呈轴对称;而反键的2p 轨道有过M-L键轴的反对称面。
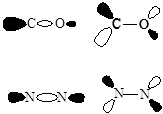
图6-2.1 CO的5s、2p和N2的3sg、1pg的轨道图形
(黑和白色表明轨道的位相相反)
对于Cr原子,电子组态为:![]() 。在配合物Cr(CO)6 中的Oh晶体场作用下, 电子组态可变为:
。在配合物Cr(CO)6 中的Oh晶体场作用下, 电子组态可变为: ![]() , 用6个空的
, 用6个空的![]() 杂化轨道分别与6个CO占据的5s 轨道组合形成6个定域的s 轨道, CO的成键的5s电子排入而成s 配键。而Cr原子占据的
杂化轨道分别与6个CO占据的5s 轨道组合形成6个定域的s 轨道, CO的成键的5s电子排入而成s 配键。而Cr原子占据的![]() 轨道与CO空的2p轨道间形成定域的p 轨道,Cr的d电子流入CO的反键2p 轨道成p 配键。由于该键形成时电子流向与s 配键的电子流向正相反,故称为反馈p键,而整个配键称之为 s-p电子授受配键, 如图6-2.2所示。
轨道与CO空的2p轨道间形成定域的p 轨道,Cr的d电子流入CO的反键2p 轨道成p 配键。由于该键形成时电子流向与s 配键的电子流向正相反,故称为反馈p键,而整个配键称之为 s-p电子授受配键, 如图6-2.2所示。

![]()
![]() 5s 2p s-p 电子授受配键
5s 2p s-p 电子授受配键
图6-2.2 CO 与Cr 原子间的s-p 电子授受配键
(黑白和白色表明轨道占据与未占据)
这样,Cr(CO)6中s-p 电子授受配键的形成, 降低了C与O间的成键度,并使M-C键具有双重键的特性。实验已测得在Ni(CO)4 配合物中, Ni-C 键键长为0.182nm, C-O键键长为 0.115nm,而正常的Ni-C 单键长度是0.192nm,在自由分子中C-O键键长是0.113nm,与羰基配合物中存在s-p 电子授受配键的分析结论相一致。
在配合物s-p电子授受配键的形成过程中,s 配键与反馈 p 键是同时产生的,是一协同过程。s 配键的形成将增加电负性低的金属的负电荷,使其不稳定;而反馈p键的形成将降低中心金属的负电荷。因此s配键的形成有利于p配键的形成,反之亦然,互相促进、增强,产生协同效应。
.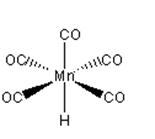
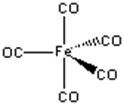
(a) (b)
图6-2-3 (a)Fe(CO)5和(b)HMn(CO)5的结构
CO 与过渡金属间可形成强配位键而络合的现象对人的生命活动有重要意义。人用血液中的血红素输送氧气,是利用血红素中的蛋白质配合物的中心铁原子上的一个配位点与氧分子的络合来实现的。人若吸入CO分子(或摄入CN-离子),由于它易与血红素中的蛋白质配合物的中心铁原子形成稳定的s-p 电子授受配键,并将占据了这个配位点,使血液失去输氧功能,而发生中毒现象。
图6-2.3 给出另外二种具有代表性的羰基配合物的分子结构。
二、 N2的配合物与固氮
N2与CO、CN- 是等电子分子,N与C和O原子在周期表在又是相邻的元素,因此这些分子具有相似的电子结构。但N2分子为同核双原子分子具有对称中心,电子组态为:KK2sg22su21pu43sg21pg0。如图6-2-1所示,它的3sg和1pg MO与CO相应的5sMO有较明显的区别,该轨道呈中心对称,与CO的5s和2pMO成分相对集中在碳原子一边相比,不利于与中心金属形成强的s-p 电子授受配键,因此N2与金属间的络合能力要明显低于CO。
因为游离态的N2 资源在大气层中十分丰富, 而化合态的氮如氨肥等对农业及国民经济的发展十分重要。因此把游离态的氮转化成化合态的氮(称为固氮)一直是化学界极其重视的课题。在常规的化学反应中,将游离态的N2分子还原成NH3需要高温、高压等苛刻条件,产率低、成本高。人们注意到在自然界里的固氮微生物,如豆科类植物根系上的固氮菌,它们在常温常压的温和条件下就可把N2高效地转化为NH3。因此化学模拟生物固氮这一研究领域在上个世纪六十年代应运而生。
实验研究发现,生物固氮是通过形成氮与金属间的配合物使N2活化来实现的。N2可与过渡金属间形成s-p 电子授受配键。考虑到3sg 轨道是一接近于非键的弱成键轨道,而1pg轨道是强反键轨道,因此d电子流入1pg轨道或反馈 p 键的形成是活化N2的主要因素。这样对中央金属就有了如下要求:(1)在反馈 p 键的形成中电子是由金属流向N2,故中心金属的正电荷不宜过高,最好在0~+1之间。实验发现+3价过渡金属离子不易与N2配合。(2)中心金属至少有二个以上d电子。 实验分析也表明,具有d5-d9组态的中心金属才易与N2形成稳定的配合物。(3)在配合物中,其它配体给电子能力越强,越有利于N2稳定配合物的形成。实验发现,在稳定的N2配合物中总有NH3、H2O和R3P等强给电子配体存在。
