第六章 配位化合物的结构与性质
 知识点三:有机金属配合物的结构和性质
知识点三:有机金属配合物的结构和性质
一、蔡斯(Zeise)盐
把乙烯气体通入PtC14的稀盐酸溶液可得蔡斯盐—K[PtCl3(C2H4)]H2O,为黄色沉淀。该盐的晶体结构已测出,络离子部分如图6-3.1所示,Pt2+和三个 Cl-共面,该平面垂直平分乙烯的碳—碳键。乙烯的这种配位方式叫侧基配位。
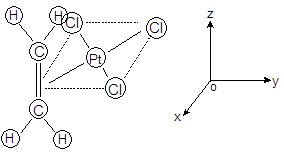
图6-3.1 [PtCl3(C2H4)]-的结构
络离子中Pt2 +的电子组态为:5d86s06p0。因Pt2+处于方形的配位场中,5![]() 能级最高为空轨道,可进行dsp2(6s、6px、、6py)杂化成键。三个Cl的3p孤对电子轨道与三个Pt2+ 空的dsp2 杂化轨道分别组成σ型轨道而形成σ配键,余下的空dps2 杂化轨道与乙烯的成键π-MO满足图中C2 轴的轴对称,可线性组合成一种三中心σ配键。
能级最高为空轨道,可进行dsp2(6s、6px、、6py)杂化成键。三个Cl的3p孤对电子轨道与三个Pt2+ 空的dsp2 杂化轨道分别组成σ型轨道而形成σ配键,余下的空dps2 杂化轨道与乙烯的成键π-MO满足图中C2 轴的轴对称,可线性组合成一种三中心σ配键。
二、σ-π电子授受配键
在Pt2+和乙烯间形成σ配键的同时,Pt2+ 的双占据的5![]() 轨道与乙烯反键π轨道(π未占据)间满足分子平面(Pt2+为坐标原点时的 XY 平面)反对称,形成π型MO,d电子填入形成π配键。由于Pt2+和乙烯间σ配键的形成,是乙烯的成键电子流入Pt2+的空杂化轨道,而π配键的形成是Pt2+的d电子流入乙烯的反键π轨道,流向相反,又称该π配键为反馈π键。称两者间形成σ-π配键或σ-π电子授受配键。
轨道与乙烯反键π轨道(π未占据)间满足分子平面(Pt2+为坐标原点时的 XY 平面)反对称,形成π型MO,d电子填入形成π配键。由于Pt2+和乙烯间σ配键的形成,是乙烯的成键电子流入Pt2+的空杂化轨道,而π配键的形成是Pt2+的d电子流入乙烯的反键π轨道,流向相反,又称该π配键为反馈π键。称两者间形成σ-π配键或σ-π电子授受配键。
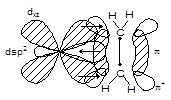
图6-3.2 Pt2+和乙烯间σ-π配键的形成
Pt2+和乙烯间σ-π配键的形成增强了两者间的键合作用。Pt2+ 与乙烯双键间的距离远小于Pt-Cl间的距离。更重要的是配位后乙烯中的双键,因成键π电子流入Pt的空d轨道和Pt的d电子流入乙烯的反键空π轨道,使双键键长由133pm变成137pm,被明显削弱和活化。烯烃的络合催化理论就是在此基础上发展起来的。
具有d10 电子结构的过渡金属如Ag+,也易与乙烯形成σ-π 配键。与蔡斯盐中情况相似,Ag+中的5s空轨道与乙烯的成键π 轨道间也满足轴对称,形成σ配键,反馈π键的形成完全相同。具体情况如图6-3.3所示。
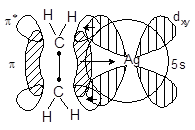
图6-3.3 Ag+和乙烯间σ-π配键的形成
