第八章 晶体的结构与晶体材料
 知识点四:共价键型晶体、分子型晶体和
混合键型晶体的结构与应用
知识点四:共价键型晶体、分子型晶体和
混合键型晶体的结构与应用
一、共价键型晶体的结构
1.共价键型晶体及其特性 根据哥希密特结晶化学定律,当离子极化作用增大,原子间共价键成份增大,离子晶体中的键型从以离子键为主过渡到以共价键为主。由于共价键的饱和性和方向性限制导致配位数降低,构型发生改变,这时离子晶体转变为共价键型晶体。
所谓共价晶体是指原子间通过共价键结合起来的晶体。
共价型晶体的结构特征决定这类晶体性质的特殊性。由于共价型晶体内键的饱和性和方向性,决定了这类晶体不具有象金属那样的延性、展性和良好的导电性、导热性;又由于共价键的结合力比离子键的结合力强,一般说来其硬度较大,熔点较高。
2.典型共价键型晶体
(1)金刚石是最典型的共价晶体 金刚石中每个碳原子通过sp3杂化轨道与其它碳原子形成共价键,故配位数为4。把C-C作为结构基元,其点阵型式为立方面心,属立方ZnS型结构(见图8.3.1)。ZnS晶体中由于离子极化作用,Zn与S之间形成极性共价键,离子的配位数比为4:4,也是共价型晶体。其点阵型式有立方面心和六方两种。另外AgI、CuF、CuCl、CuBr、CuI等也是六方ZnS型结构的AB型共价晶体。
(2)AB2型共价晶体 白硅石(SiO2)也是ZnS型共价晶体。如图8.4.1,Si占据了立方ZnS晶体中Zn和S的位置,两个Si之间加一个O原子。其配位数比为4:2,属于这一构型的晶体还有BeF2等。
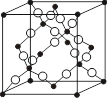
图8.4.1 白硅石的结构
3.共价半径 由于共价型晶体独有的结构特征,决定了这种类型的晶体中原子的共价半径并不受密堆积的制约。在共价型晶体中,原子的共价半径与共价键分子中完全一致。
对于其它共价型晶体,如ZnS、SiO2等AB型或AB2型共价晶体来说,也同样是以A-B键的键长分配给A原子和B原子,分别作为它们的共价半径。其推求方法可以同离子半径求法相类似,但其含义却有所不同。离子半径是指离子晶体中正、负离子的“接触半径”;而共价半径却是指形成共价键的各原子的“表观半径”。显然,即使对于同一元素而言,它的离子半径和共价半径的数值是不相同的。
二、分子型晶体的结构
分子型晶体是指单原子分子或以共价键结合的有限分子由范德华(Van der Waals)力或氢键等弱键凝聚而成的晶体。我们分三类介绍之。
1.惰性元素晶体
惰性气体(稀有气体)是单原子分子,在足够低的温度下因范德华力而凝聚成惰性元素晶体。严格地讲只有这类晶体才是可供单独地研究范德华力性质的唯一分子晶体。范德华力和金属键极为相似,一般不具有饱和性和方向性。所以隋性元素晶体都具有和典型金属一样的最密堆积结构。Ne、Ar、Kr、Xe晶体均为立方最密堆积(A1),He晶体为六方最密堆积的结构。因范德华力极弱,惰性元素的晶体都具有熔点很低,热澎胀系数大和升华热低等物理化学性质。
2.共价分子晶体和原子的范德华半径
(1)共价分子晶体 接近球形的共价分子或通过旋转呈球形的共价分子因范德华力形成晶体时,往往也为最密堆积的结构型式。例如,H2晶体为六方最密堆积,HCl和H2S等晶体为立方最密堆积。CO2晶体(干冰)以及平面苯分子形成的固体等也是立方密堆积或变形的立方密堆积排列。
CO2晶体是典型分子晶体。如图8.4.1所示,晶体中分立的直线型O-C-O分子以碳原子排列在立方晶胞的顶点和面心位置上,形成了以分子的中心作立方密堆积排列;同时,CO2分子的轴平行于立方体体对角线,使分子本身尽量适应分子的非球形形状而紧凑堆积。相邻分子的氧原子间距约为310pm。
C60晶体或其他富勒烯晶体其显微图象显示或X射线测定,“就像一大堆真的足球一样,C60分子按六方或立方密堆积方式排列”。C60中心间的平均间距大约是1nm。这完全合乎情理,因为单个C60分子的直径大致为0.7nm,剩下的那0.3nm还要留给每个C60分子球外面包围的那层电子云。
(2)原子(或基团)的范德华半径 “范德华半径”就是指当分子以范德华力结合时,两相邻近分子相互“接触”的原子所表现出的半径。例如Cl2分子晶体中,两邻近分子的相互“接触”的两个Cl原子间的距离,经实验测定约为360pm,它的一半180pm就是Cl的范德华半径。这一数值比Cl的共价半径99pm要大得多,而与Cl-半径181pm相接近。
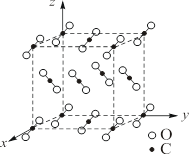
图8.4.1 CO2分子晶体结构
3.氢键和氢键型晶体
(1)氢键 当H原子与电负性大的X原子形成共价键时,在H原子上有剩余作用力,可与另一电负性大的Y原子形成一种“较强的、具有方向性的范德华力”。如X-H…Y中,X-H是具有极性的共价键,H…Y就是所谓的氢键。分析氢键的本质,它具有共价键相似的方向性、饱和性,而键能却比共价键小,比范德华力大,因而氢键是一种特异的键型。
(2)氢键型晶体 分子间以氢键相连结所形成的晶体叫氢键晶体。如冰,NaHCO3晶体等。在氢键型晶体中,有用分子间氢键连接成链状、层状或形成骨架等多种构型。
冰为典型的氢键型晶体结构。常压下,水冷至0°C以下即可结晶成六方晶系的冰-Ih。日常生活中见到的冰、霜、雪等都属于这种结构型式。图8.4.3示出冰-Ih的六方晶胞。0°C时,六方晶胞参数为:a=452.27pm,c=736.71pm;晶胞中包含4个H2O分子,空间群为![]() ;其密度为0.9168g × cm-3。
;其密度为0.9168g × cm-3。
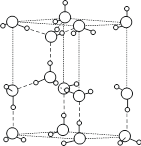
图8.4.3 冰-Ih 的结构
在冰-Ih中平行于六重轴方向的O-H…O的距离为275.2pm,而其他3个为276.5pm,ÐOOO非常接近于109.5°。
在整个冰的晶体结构中每个H原子都参与了氢键的形成,这是因为它服从“最大限度生成氢键原理”,尽可能多地生氢键,可以最大限度地降低体系的能量,以增强晶体结构的稳定性。这样,每个O原子周围都有4个H原子,由图8.4.4可以看出,2个H距O较近,以共价键结合;另2个H距O较远,则是以氢键相连。O的配位数为4,为了形成较稳定的四面体型结构,水分子中原有的键角(105°)也稍稍扩张,使各键之间都成为四面体角(109.5°)。这种结构是比较疏松的,因此冰表现出密度比水小的特殊性质。当冰熔化成水时,部分氢键遭到破坏,而水中仍保持有许多运动自由的氢键结合成的小集团,且不断地变动改组。由于这些小集团可以堆积得较为紧密,因而冰熔化时体积反而缩小,密度变大。从冰的六方晶系结构模型出发,即不难推理出雪花为六角晶形由来的基本内在因素。
三、混合键型晶体的结构
1.混合键型晶体及石墨晶体的结构
内部结构包含有两种以上键型的晶体,可统称为混合键型晶体。这类晶体中的典型例子就是石墨晶体(如图8.4.4)。
石墨的结构。石墨晶体中的C原子通过sp2杂化轨道以共价s键与其它C原子连接成六元环形的蜂窝式层状结构,在层中C原子的配位数为3,每两个相邻C原子间的键长为142pm;另外,每个C原子还有一个垂直层平面的p轨道,可以形成贯穿全层的多原子的大p键。石墨晶体的能带结构因其存在导带因而具有良好导电性。石墨晶体层与层间的距离为340pm,远大于一般的C-C键长,实际上是由范德华力相互连结。由于范德华力远较化学键弱,使得层与层之间易于滑动,表现出了石墨晶体所特有的滑腻性质。
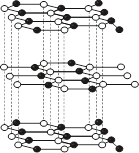
图8.4.4 石墨晶体结构
