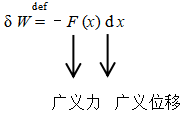当前位置:课程学习>>第一章 热力学第一定律>>知识讲解>>视频课堂>>知识点一
知识点一:热力学的基本概念
一、过程和途径
1、变化:系统状态的改变。只考虑始终态。
(1)简单状态变化:仅T,p,V变化。
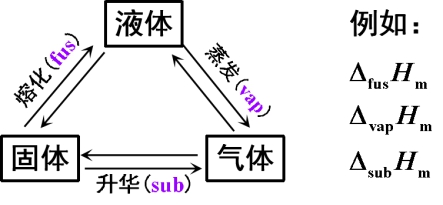
(2)相变化:s ![]() l( 熔化“fus”);l
l( 熔化“fus”);l![]() g(蒸发“vap”);s
g(蒸发“vap”);s![]() g(升华“sub”);s
g(升华“sub”);s![]() s(晶型转变“trs”)
s(晶型转变“trs”)
(3)化学变化:即化学反应
2、过程:状态变化的经历。涉及中间态和环境的作用。
(1)等温过程:T1=T2=T环,T环=常数
(2)等压过程:p1=p2=p环,p环=常数
(3)等容过程:dV=0
(4)绝热过程:δQ=0
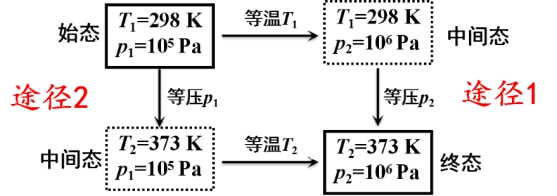
3、途径:完成某一变化的具体步骤或路线。
二、热和功
系统状态发生变化时,系统与环境之间的能量传递有“热”和“功”两种形式。
热(Q):温度差异而交换的能量。无序运动。
功(W):除热以外而交换的能量。有序运动。
热和功均为过程量,而不是状态函数。微小量:“δQ”, “δW”
正负号规定:系统吸热:Q>0,系统放热:Q<0。系统对环境作功:W<0,环境对系统作功:W>0。
功的形式:
机械功:δW= - Fdx
电功:δW= - EdQ
表面功:δW=γdA
体积功: