第一章 热力学第一定律
 知识点一:热力学基本概念
知识点一:热力学基本概念
一、系统与环境
物质世界在空间和时间上都是无限的。人们在研究具体事物时必须先确定所需研究的对象,把它从其他事物中划分出来,并确定其范围和界限,这一研究对象及其空间称为系统。环境是系统以外且与系统密切相关的物质及其所在空间。需要注意的是:
(1)系统与环境是根据研究的需要人为划分的,系统一经确定,在研究过程中就不允许随意变更。
(2)系统与环境间不一定存在实际的界面,环境必须是与系统有相互影响的有限部分。
(3)热力学中定义的系统与环境,它们是宏观的系统与环境,既无统计涨落又非无限大的情况。
根据系统与环境间的相互影响关系,系统又可以分为以下三类:
敞开系统:与环境间既有能量交换又有物质交换的系统;
封闭系统:与环境间只有能量交换而无物质交换的系统;
孤立系统:与环境间既无能量交换又无物质交换的系统。
事实上,自然界中一切事物总是相互关联和相互影响的,严格而言,孤立系统(又称隔离系统)只是一种假想的系统,它只能在有限的时间和空间内存在,通常把某些与环境联系相当微弱的系统近似作为孤立系统处理。
例题1 将一杯水放进一个封闭的绝热箱中,试确定系统、环境。
解:(1)若选水为系统,绝热箱及其中空气为环境。因环境中原来无水蒸气,水必然会部分蒸发为水蒸气逸入箱内,同时从空气中吸收热量,所以水为敞开系统。
(2)若选水及绝热箱内的水蒸气为系统,则为封闭系统。虽然水变成水蒸气需从空气中吸收热量,但由于水蒸气来源于水,属于系统的一部分,所以说系统与环境间无物质交换。
(3)若选绝热箱及其内部的所有物质为系统,箱外的空气为环境,则此系统为孤立系统。显然,该系统与环境间无物质交换和能量交换。
二、状态、状态变量与状态函数
系统里一切宏观性质的综合称为状态。一个确定的系统具有一定的状态,描述系统状态的宏观物理量称为热力学性质或状态性质,它是系统的属性,同一系统的各个状态性质之间是相互关联和制约的,通常可用连续函数来表达。当系统中某几个性质确定后,其他所有的性质随之而确定,所以描述一个系统的状态,无需把所有的性质都加以说明。例如,对理想气体,可以把描述状态性质的等式V = nRT/p,用V = V(n,T,p)的函数关系式来表示。这就说明,只要该系统物质的量、温度和压力确定后,系统的体积也随之确定,再将其与气体物性的有关公式结合起来,可将此时气体的密度、折射率、粘度、导热系数等其他属性全都确定。我们把n、T、p这类作为描述气体状态所需的最少独立变量称为状态变量或状态参量,而把V这类依赖其它状态变量的状态性质称为状态函数。状态函数和独立状态变量之间的函数关系式称为状态方程式。同理,我们可选用p = p (n,T,V)这样的函数关系式来描述理想气体的状态性质,这里的V是状态变量,而p成了状态函数,由此可见,状态函数与状态变量并非是绝对的。通常根据研究系统的特点、复杂性和处理问题的需要,选择系统几个易于测定的热力学性质作为独立变量,其余的状态性质都与这些独立变量存在某种函数关系(有时不一定能以简单函数形式表示出来),可表示为这些独立变量的函数。
物质的性质可分为宏观性质和微观性质,在热力学中讨论的是系统的宏观性质,简称性质,如温度、压力、体积、热容、密度等。根据性质的数量是否与系统中物质的数量有关,可将其分为广度性质和强度性质。前者的特点是与系统中物质的量有关,又称容量性质,它在一定条件下具有加和性,如质量、体积、热力学能、熵等,整个系统的广度性质是系统中各部分该量的总和,而强度性质与系统中物质的量无关,不具有加和性,其数量取决于物质本身的特性,如:压力、温度、密度等。广度性质与广度性质之比得强度性质,如V/n = Vm。显然,广度性质与强度性质的乘积为广度性质。
状态函数有如下特点:(1)系统处于定态时,状态函数有定值。如1mol理想气体,在0℃和标准态压力(105Pa)下,其体积总是22.71dm3,这完全由该系统所处的状态所决定,而与系统在此之前的经历无关;无论经历加热、冷却、膨胀或压缩,只要1mol理想气体能恢复到0℃和标准态压力,它的体积总是22.71dm3。(2)系统的始、终态确定后,状态函数的改变量是一定的。例如,把上述理想气体所处的状态(称始态或初态)变化到25℃和0.1标准态压力的状态(称终态或末态),其体积变化一定是(247.88-22.71)dm3=225.17dm3。所以,系统从指定的始态出发,不论经过怎样的途径,只要到达同一状态,其状态函数的变化量总是一定的。(3)系统恢复到原状态,状态函数也恢复到原来的数量,即状态函数的变化为零。(4)状态函数在数学上具有全微分的性质,可按全微分的关系来处理,其微量变化冠以“d”,如dp、dV等。
如果外界条件不变,系统的所有宏观性质都不随时间变化,则系统就处于热力学平衡状态。热力学平衡一般包括热平衡、力平衡、相平衡和化学平衡,当系统的温度、压力、几个相中各组分的物质的量均不随时间变化时,系统即处于平衡态。以下在讨论系统状态时,若无特别说明,都是指系统处于一定的热力学平衡状态。
三、过程和途径
若系统的各种性质都确定时,则系统处于一定的状态。当系统在两个不同的时刻,存在着不同的状态,这就意味着系统发生了变化。系统发生状态变化的方式称为过程(process)。过程则涉及为完成状态变化系统所经历的一系列中间状态以及与环境的作用。完成某一变化的具体步骤称为途径。例如,在25℃和标准态压力下,
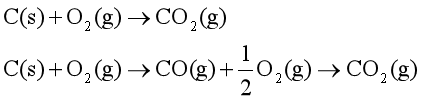
这两组反应从相同反应物质的相同状态开始,完成反应后最终得到相同产物的相同状态,只是化学过程经过两条不同的途径。
根据情况的不同,可将系统中物质状态的变化分为单纯的p、V、T变化、聚集状态变化即相变化、化学变化这三类。实际上,系统所经历的变化可以是其中的一类或兼而有之。实现上述变化的过程主要有以下几种:
(1)等温过程:系统始态(1)和终态(2)的温度与环境温度相同的变化过程,即T1 = T2 = T环,过程中系统的温度可以不恒定。如果系统变化过程温度恒定,则称为恒温过程。
(2)等压过程:系统的始态(1)和终态(2)的压力与环境压力相同的变化过程,即p1 = p2 = p环,过程中系统的压力可以不恒定。如果系统变化过程压力恒定,则称为恒压过程。
(3)等(恒)容过程:系统在变化过程体积保持恒定的过程。
(4)绝热过程:系统与环境间无热量传递的变化过程。实际上完全的绝热过程是很难实现的,若过程进行极迅速,系统来不及与环境进行热交换,便可近似认为是绝热过程。例如:当玉米颗粒在弹形容器中被加热至一定温度和压力时,突然开启阀门的瞬间可视为绝热过程;在深海中的洋流,循环一次短则几年,长则数十年,时间虽然较长,但由于海水质量非常大,热容量也极大,洋流与环境交换的热量可以忽略,可看作是绝热过程;大气对流层中,大气压强随高度增加而减小,空气在垂直地面方向的对流也可近似为绝热过程,并据此可对一些现象作出满意的解释。
(5)循环过程:系统由某一状态出发,经过一系列变化又回到原始状态的过程,称为循环过程。
须指出的是,实际过程远不止上述五种,例如理想气体p/V为定值的过程也是单纯的状态变化。
