第一章 热力学第一定律
 知识点三:准静态过程和可逆过程
知识点三:准静态过程和可逆过程
一、体积功
在一定的环境压力下,当系统的体积发生变化时,系统对环境做的功(膨胀功)或环境对系统做的功(压缩功)都称为体积功。设有一汽缸的截面积为A,筒内有一无质量无磨擦力的理想活塞, 并有外力ƒe作用于活塞上,汽缸内盛有气体.若系统抵抗外力ƒe,使活塞向上移动了dl距离,则系统做的膨胀功
δW = -ƒe·dl(3)
因为 ƒe/A = pe 及 Adl = dV
所以 δW = -pedV (4)
由式(1.4)可知,外压pe≠0及体积变化dV≠0是产生体积功的两个必要条件。若系统经过几个步骤完成整个变化,则所做的功为各步骤体积功的加和,即
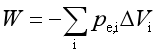 (5)
(5)
显然,当体积变化∆V >0时,则W < 0,表示系统膨胀对环境做功;当∆V < 0时,则W > 0,表示系统体积被压缩,环境对系统做功。
在计算体积功时,不论系统压力p有多大,总是以系统对抗的外压为计算功的广义力,功等于外压pe乘以位移。系统压力p与外压pe的相对大小,仅用于判断系统是发生膨胀还是压缩过程。正如举重时衡量举重运动员做功的大小,总是以他能对抗外压(杠铃的重量)的大小来衡量,而不是凭他有多大“力气”;换言之,举重运动员力气的大小是要根据他能举起多重的杠铃(引起的环境变化)来判断。又如,理想气体向真空膨胀(也称自由膨胀)过程,外压pe=0,所以不论始态时系统的内压p有多大,功W恒为零。
二、准静态过程
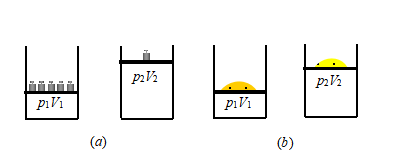
现讨论图1所示的理想气体等温膨胀过程。以带有活塞的汽缸中一定量理想气体为系统,活塞上放五个砝码,当气体的压力与重物的重量平衡时,系统处于初始平衡态,设此时气体的压力为p1、体积为V1,如图1(a)所示。现将砝码一次移去四个,气体的体积就会发生膨胀。开始膨胀时,靠近活塞处的压力要比其他部分气体的压力小,气体内部的压力是不均匀的,因此在膨胀过程中气体处于非平衡态,直到气体内部各处压力均为p2的平衡态,气体的膨胀才停止。由于在膨胀过程中,系统处于非平衡状态,其状态参量没有定值,所以无法用状态参量来描述整个过程,只能描述过程的初始和终止时系统所处的平衡状态。因此在p~V图上,可分别用A点和B点来描述系统的始态和终态,见图3所示。
![]()
若将p2、V2作为始态,逆向进行上述过程,一次性加上四个砝码,使终态达到p1、V1的平衡态,这是一个压缩过程,同理,无法用状态参量来描述这个过程的中间状态。
设想系统从始态A经膨胀达到终态B,再经压缩回到始态A,似乎状态的变化是“可逆的”,但经过这一循环后,系统的能量又将怎样呢?膨胀时活塞与汽缸摩擦产生的热释放给了环境;在压缩时,摩擦所生的热再次释放到环境中去了, 不可能将膨胀时放到环境中的热通过压缩时的摩擦而回收,即能量没有“可逆”,最终在环境中留下了变化。
若进行分步膨胀,从图2可以看出,系统从A→B,做功W1;再进行分步压缩,从B→A,则做功W2;显然,︱W2︱>︱W1︱。说明经过一个循环后,就有︱W2︱-︱W1︱的能量转化为热,即环境浪费了︱W2︱-︱W1︱的功,才得到上述数量的热,在环境中便留下不可消除的痕迹。
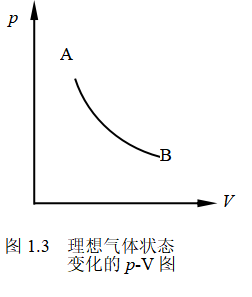
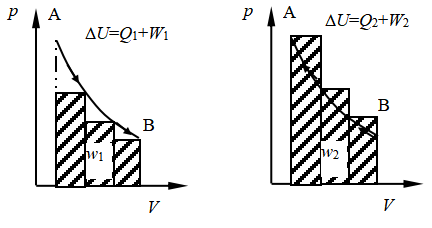
图2 膨胀(a)和压缩(b)过程的示功图
若我们设想活塞是无质量的理想活塞,而且过程进行得无限缓慢。例如,若上述膨胀过程中与始态A平衡的重物不是砝码而是无限细的砂粒,如图1(b)所示,每次膨胀时只移去一颗砂粒,使膨胀过程极其缓慢地进行,以至在过程进行的任一时刻,系统状态与平衡态的偏离总是无限小,可近似看作是平衡态。这种进行得无限缓慢,其经历的每个状态都可视为平衡态的过程,称为准静态过程。可用过程中系统状态参量的变化来描述整个准静态过程,即以一系列无限接近的描述平衡态的点来表示,实际上此过程的状态变化可用一条光滑的曲线或直线来表示,见图3所示,这样的曲线称为过程曲线。严格来说,准静态过程是一种理想过程。
三、可逆过程
无摩擦的准静态过程就是可逆过程,实际过程都是不可逆过程,两者均指的是“过程”而不是状态,它们之间的区别见表1所示。
表1 可逆过程与不可逆过程的区别
可逆过程 |
不可逆过程 |
作用于系统的力无限小,不平衡的力无限小,系统始终处于平衡状态; 过程进行的速度无限缓慢,所需的时间无限长; 无任何摩擦阻力存在,无任何能量耗散; 其逆过程能使系统与环境同时恢复原始状态; 实际不存在的理想过程。 |
1、作用力非无限小,系统至少有时处于非平衡状态; 2、过程进行的速度不是无限小,而是有确定的量; 3、有阻力存在,有能量耗散出现; 4、其逆过程不能使系统与环境同时恢复原状态; 5、实际发生的过程,但在某种情况下可使之接近于极限的可逆过程。 |
由于可逆过程的效率最高,因此可逆过程在热力学研究中有重大的理论和现实意义。实际过程通过与可逆过程的比较,可知实际过程不可逆性的程度,并能衡量提高实际过程效率的潜力。此外,一些重要的热力学函数的变化,往往需借助可逆过程才能完成具体的计算。
例2 在0℃,1mol理想气体经下列一些途径,从始态1000 kPa变化到终态100 kPa, 求各途径中气体所做的功,并在p-V图上表示出气体做功的大小。
(1)气体从始态向真空膨胀到达终态;
(2)气体从始态反抗外压100 kPa一步膨胀到达终态;
(3)气体从始态反抗外压500 kPa膨胀到达一中间态,再反抗恒外压100 kPa到达终态;
(4)气体从始态经恒温可逆膨胀到达终态。
解 按题意,过程的变化途径可如下表示:

(1)向真空膨胀,pe = 0 ,气体不做功,即 W1=0; ![]()
(2)在273K时,气体反抗外压100 kPa,一步膨胀到达终态,体系所做的功为
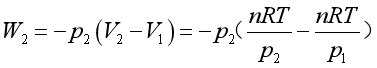 =
= 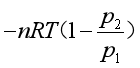
=![]()
(3)气体分二步膨胀到达终态。根据式(1.5),计算过程的功为
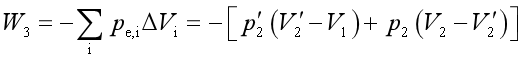
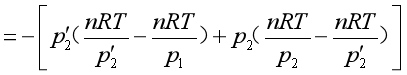
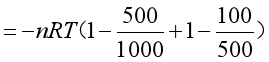
![]()
![]()
(4)恒温可逆膨胀过程。设每步膨胀都使外压pe比系统压力p小一个无穷小量dp, 即pe=p-dp,系统膨胀dV,略去二级无穷小量,并代入理想气体状态方程式,则
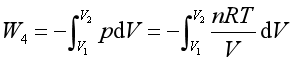
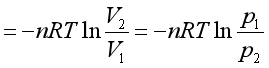
![]()
= -5226.2J
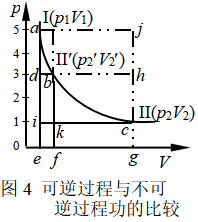
图4是以上述各过程的p-V图,从中可区分各过程所做的体积功的大小。恒温一步膨胀过程气体做的功W2与面积Seicg相当;等温分二步膨胀过程气体做的功W3与面积Sefbd+Sfgck相当;等温可逆膨胀过程气体做的功W4与面积Seacg相当。
上述计算结果表明,四种过程做功的大小顺序为:∣W1∣<∣W2∣<∣W3∣<∣W4∣。如果将过程逆向进行,即该系统始终在外压比系统压力大dp的情况下,恒温由p2、V2压缩回到p1、V1状态,环境此时对系统做功为
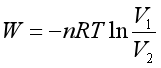
将其与W4比较可知:系统经恒温可逆膨胀和恒温可逆压缩后,环境得的功为W4+W =0,与系统做的净功相等。系统和环境都恢复到原状态,热力学能变为△U=0。根据热力学第一定律,则环境得热Q=0。所以,系统经可逆变化后可恢复原状,且环境没有热和功的得失,也能恢复原状;除此以外,其它三个过程进行后,当系统恢复原状时,环境损失了功而得到了热,即在环境中留下了痕迹,所以它们均为不可逆过程。
由此可见,恒温条件下,系统对环境做的可逆膨胀功最大,环境对系统可逆压缩消耗的功最小。
