第一章 热力学第一定律
 知识点四: 焓和热容(热的计算)
知识点四: 焓和热容(热的计算)
一、等容热、等压热和焓
无论是在理论研究还是在实际化学工程中,对过程热的研究有着很重要的意义。经常遇到的是不作其他功的等容或等压条件下的热量,简称等容热QV和等压热Qp,Q的右下角注V、p分别表示等容和等压。
![]() 的等容过程,△V = 0,则W = 0,由热力学第一定律可得
的等容过程,△V = 0,则W = 0,由热力学第一定律可得
△U = QV 或dU = δQV (6)
此式表明,封闭系统在不做其它功的等容过程,实验量等容热QV在量值上等于热力学能变△U。
若用右下角注1、2分别表示系统的始态和终态,在等压过程并只作体积功时,由热力学第一定律可知,等压热为
Qp= △U-W = △U+pe△V =(U2-U1)+pe(V2-V1)
等压过程,p1 = p2 = pe,上式可表示为:
Qp= U2-U1+p2V2-p1V1= (U2+p2V2)-(U1+p1V1)
定义H = U + pV,H称为焓,则
Qp = H2 -H1 =△H ,或 δQp =dH (7)
式(7)表明,封闭系统在不做其它功的等压过程,实验量等压热Qp在量值上等于焓变△H。上述式(6)、(7)对测量和计算化学反应的焓变很有实用价值,并可使有关的数学处理简化。
由于U、p、V都是状态函数,H也一定是状态函数,在确定的始、终态间,系统的焓变△H为一定的量。焓属系统广度性质,虽具有能量单位,但其绝对量无法求得。
孤立系统的热力学能是守恒的,当系统内发生一定变化时,热力学能变△U = 0,但系统的焓变△H不一定等于零。例如,在恒容的绝热反应器中发生一个化学反应,系统不做体积功,W = 0,又因绝热,Q = 0,所以系统的热力学能变△U = 0,由于该反应器中发生了化学反应,系统的温度、压力会有变化,故系统的焓变△H≠0,显然,此时的焓变不是系统变化过程的能量变化。
二、热容
在不发生相变和化学变化的条件下,若加热一封闭系统,则系统必须吸收热。通常以测定系统温度的升高来表征其吸热的多少,显然,系统温度的升高ΔT和吸收的热Q成正比,取比例系数为![]() ,则
,则
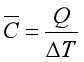
定义![]() 为系统的平均热容,它表示在ΔT温度区间内,系统每升高单位热力学温度所需吸收的热。在不同的温度区间,系统同样升高单位热力学温度所需吸收的热不同,因此欲求在某温度时系统的热容,必须将温度区间缩至很小,即
为系统的平均热容,它表示在ΔT温度区间内,系统每升高单位热力学温度所需吸收的热。在不同的温度区间,系统同样升高单位热力学温度所需吸收的热不同,因此欲求在某温度时系统的热容,必须将温度区间缩至很小,即
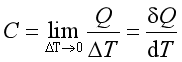 (8)
(8)
热容的单位是J·K-1,它是一个广度量,与系统物质的量有关。单位质量物质的热容称为质量热容或比热,用C表示,单位为J·K-1·kg-1。单位物质的量的热容称为摩尔热容,用Cm表示,单位为J·K-1·mol-1。比热和摩尔热容均是强度量。
由于热与变化途径有关,式(1.8)中的δQ不是全微分,所以若不指定加热方式,热容是一个不确定的物理量。若在等容或等压情况下加热,它们可分别定义为等容热容CV和等压热容Cp:
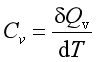 和
和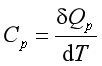
对于单位物质的量,则分别称为摩尔等容热容CV,m和摩尔等压热容Cp,m。
对一定量的物质系统,若以T、V作为独立变量,则热力学能的全微分dU可表示为
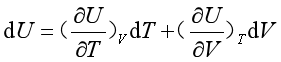
当体积不变时
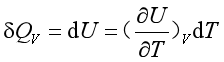
故等容热容可表示为
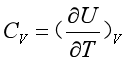 (9a)
(9a)
或等容时
![]() (9b)
(9b)
同理,若选择T,p作为焓的独立变量,则可得等压热容为
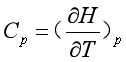 (10a)
(10a)
或等压时
![]() (10b)
(10b)
系统的热容是温度T的函数,具体的函数关系式,随物质聚集状态、温度范围的不同而异。由于Cp比CV更常用,在热力学数据手册中常收录物质的摩尔等压热容的两种经验式:
CP,m= a + bT + cT2 + … 或Cp,m= a + bT + c`T-2 + … (11)
式中a、b、c、c`各为经验常数,由物质的本性等决定,可通过实验测定求得,Cp,m的单位J·mol-1·K-1。
在等容下,定积分式(9b),可得
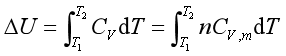 (12)
(12)
在等压下,定积分式(10b),可得
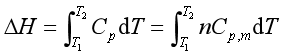 (13)
(13)
应用式(12)和式(13)需注意,在温度变化范围里系统的物质仅发生单纯的状态变化、无相变和化学变化。
三、Cp与CV的关系
采用等压或等容的加热方式,加热一组成不变的均匀封闭系统,若升高相同的温度,则系统吸收的热是不同的。从式(10)可知,在等压、只作体积功的过程,系统吸收的热除有部分转化为系统的热力学能外,还有一部分热转化为反抗外压做的体积功,而等容过程吸收的热仅转化为系统的热力学能,所以一般情况下Cp与CV是不相等的。
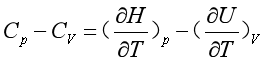
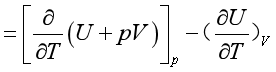
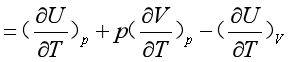 (14)
(14)
设封闭系统的热力学能U =f(T.V), 其全微分
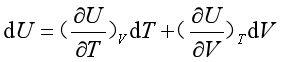
在等压p下,等式两边同除以dT ,得
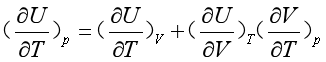 (15)
(15)
式(13)代入式(12),得
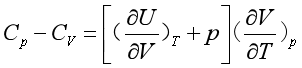 (16a)
(16a)
或 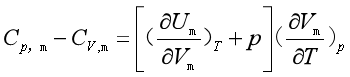 (16b)
(16b)
应当指出,式(14)(16a)、(16b)的关系适用任何封闭系统。
四、理想气体的热容
理想气体的热力学能U仅是温度的函数,所以![]() 。理想气体的体积V =nRT/p,所以
。理想气体的体积V =nRT/p,所以![]() 。将这两个关系式代入式(16a)和(16b),分别可得
。将这两个关系式代入式(16a)和(16b),分别可得
![]() (17a)
(17a)
或 ![]() (17b)
(17b)
根据气体分子运动论,对于单原子分子,除去其中电子与原子核内的能量外,可以认为它只具有平动运动,1mol单原子分子理想气体的热力学能为:
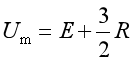
式中的E是1mol气体分子的电子和原子核内能量的总和,它不受温度的影响(核反应与热核反应除外),所以
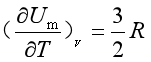 (18 )
(18 )
即单原子分子的理想气体,CV,m=(3/2)R ;若是线形多原子分子,还需考虑转动因素,CV,m,=(5/2)R;非线形多原子分子的CV,m=(6/2)R;说明理想气体的摩尔热容为常量,与温度无关。
在相当高的温度,双原子及多原子分子的CV,m要增大,这是因为它的分子中各原子间还有振动运动,这种振动运动能量是量子化的,其间能量差较大。在普通温度或低温时,大多数分子的振动运动都处于基态,只具有零点振动能,分子的振动运动被激发的机会较少(光化学或激光化学反应除外),此时振动运动对CV,m没有贡献。在相当高的温度时,分子的平均动能已相当大,分子间的碰撞足以使振动运动被激发到第一激发态或更高的激发态。温度愈高,这种激发的可能性愈大,其结果是分子的振动运动的平均能量随温度升高而不断增大。例如,H2(g)在不同温度时CV,m的实验值如下:
T/K 273 773 1273 1773 2273 2773
CV,m/J·K-1·mol-1 20.29 21.23 22.95 25.06 26.72 27.98
以上数据证实了上述的理论推测是合理的。
物质的等压热容与等容热容之比Cp/CV是一个重要的物理量,称为热容比,以符号![]() 表示:
表示:
![]() = Cp/CV
= Cp/CV
显然,![]() 也是温度的函数,随气体分子的复杂性而减小。理想气体的热容比为常量,单原子气体
也是温度的函数,随气体分子的复杂性而减小。理想气体的热容比为常量,单原子气体![]() =1.67,双原子分子气体
=1.67,双原子分子气体![]() =1.40;叁原子分子气体
=1.40;叁原子分子气体![]() =1.33。
=1.33。
五、相变过程的焓变
在自然现象、科学实验、生产实践中,经常会遇到含有两个相以上的多相系统。我们把系统内物理性质和化学性质均匀的部分称为相(phase)。相与相之间存在界面,原则上可用机械的方法将不同的相分离。系统中同一种物质在不同相之间的转化称为相变。我们把物质处于热力学平衡条件下发生的相变称为可逆相变,如液态水在标准大气压下,100℃时蒸发为水蒸气的过程等;而把物质处于亚稳状态或非平衡状态下发生的相变称为不可逆相变,如在标准大气压py下,过冷水的结冰过程等。
在此只讨论纯物质的相变过程。常见的相变过程有熔化(fusion)、蒸发(evaporation)、升华(sublimation)、晶形转化(crystal transition)四种过程:
![]() ;
;![]() ;
;![]() ;
;
![]()
相变过程的摩尔熔化焓、摩尔蒸发焓、摩尔升华焓及摩尔转变焓可分别以ΔfusHm、ΔvapHm、ΔsubHm及ΔtrsHm表示。通常可在有关手册上查到常见物质在正常状态下(标准大气压力、相变温度时)的摩尔相变焓。在讨论相变焓时需注意相变进行的方向,如在相平衡温度和平衡压力下,物质的摩尔凝固焓![]() ,摩尔凝结焓
,摩尔凝结焓![]() ,摩尔凝华焓
,摩尔凝华焓![]() 。
。
在恒温、恒压下,若系统进行的蒸发或升华相变过程发生在远离临界温度,液体或固体的体积与蒸发或升华后气体的体积相比可以忽略,即体积变化△V可近似视为等于气体的体积Vg,若气体遵循理想气体行为,则功
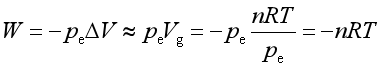
热力学能变为
ΔU =ΔH-Δ(pV) ≈ΔH-pVg≈ΔH-nRT
或ΔU = Qp+ W≈ΔH-nRT
所以,Qp=ΔH, 即相变过程的恒压热在量值上等于相变焓。
纯物质熔化和晶型转变是凝聚态之间的相变化过程,此过程系统体积的变化很小,体积功的数值W = -pΔV ≈0,Qp≈ΔU ,ΔU≈ΔH。所以,恒温恒压下,纯物质凝聚态之间相变过程的恒压热等于热力学能变及相变焓。
物质的相变焓是温度和压力的函数。与温度相比,压力对相变焓的影响较小,在通常情况下可以忽略。在较精确的计算中,需考虑相变焓与温度的关系。若相变过程在非恒压下进行,需注意此时Qp≠ΔH。
例3 已知在100℃和标准大气压下 ,1kg水完全变成水蒸气需吸热2246.8kJ。试计算在标准大气压下,110 ℃的过热的水蒸发为同温度的水蒸气需要吸热多少?已知水蒸气和水的等压比热容分别为1.866kJ·kg-1·K-1和4.184 kJ·kg-1·K-1。
,1kg水完全变成水蒸气需吸热2246.8kJ。试计算在标准大气压下,110 ℃的过热的水蒸发为同温度的水蒸气需要吸热多少?已知水蒸气和水的等压比热容分别为1.866kJ·kg-1·K-1和4.184 kJ·kg-1·K-1。
解 恒温、恒压下,过热水蒸发为水蒸气是不可逆相变过程。过热水蒸发所吸的热不易测定,但蒸发是在恒压条件下进行的,![]() ,故可设计如下的途径,分三步来实现此变化,并求过程的焓变。
,故可设计如下的途径,分三步来实现此变化,并求过程的焓变。
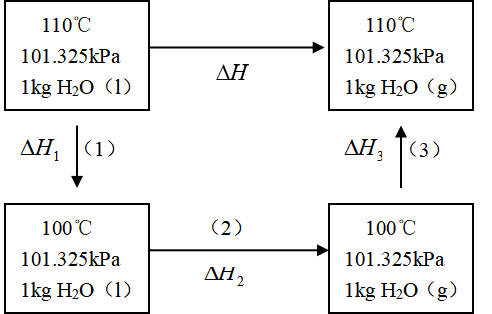
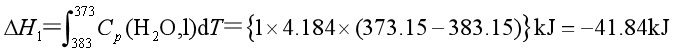
![]()

根据状态函数的性质,有
![]()
![]()
例4 在373.15K、标准大气压下,将0.056mol水蒸气恒温恒压压缩至体积为10-3m3的水蒸气,求该过程的Q、W、![]() 、
、![]() 。已知水的摩尔蒸发焓为40.66kJ·mol-1,水和水蒸汽的密度分别为10-3kg·m-3和0.6 kg·m-3。
。已知水的摩尔蒸发焓为40.66kJ·mol-1,水和水蒸汽的密度分别为10-3kg·m-3和0.6 kg·m-3。
解 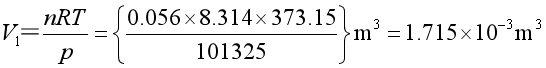
![]()
在压缩过程必然有部分水蒸气凝结为水,由水蒸气的始态体积V1、终态体积V2,求凝结成水的量为
![]()
相变热、热力学能变及相变焓分别为
![]()
![]()
