一、填空题
1、系统达到热力学平衡态时,需要满足: 平衡、 平衡、相平衡和化学平衡这四个平衡条件。
2、热力学第一定律的数学表达式为 ;其适用条件是
在 系统中。
3、化学反应的等压热![]() 和等容热
和等容热![]() 之间的关系为 ;
之间的关系为 ;![]() 与
与![]() 之差一项,所对应的物理意义是 。
之差一项,所对应的物理意义是 。
4、等压过程的定义是: 。体积功的定义式![]() 。
。
5、热是由于系统与环境之间存在 而传递的能量;功
是 而传递的能量。
6、热力学的可逆过程是通过原过程的逆过程可以使系统回到始态,同
时 不留下 的过程。
7、按热力学的规定,气体的标准态是 ;液体和固体的标准态是 。
8、对理想气体N2而言,其Cp,m = R,热容比![]() 。
。
9、焦耳—汤姆逊系数的定义式为![]() 。若某实际气体的
。若某实际气体的![]() 大于零,则经节流膨胀后温度 。
大于零,则经节流膨胀后温度 。
10、反应N2+3H2==2NH3,,如果从反应开始经过1 min生成了2 mol的NH3,,则反应进度![]() 。若反应计量方程写作:
。若反应计量方程写作: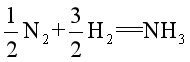 ,,则反应进度
,,则反应进度![]() 。
。
二、判断题(对者写“√”,错者写“×”)
1、在某一封闭系统中,当始态和终态确定后,如果经历一个绝热过程,则功有定值。
2、在等压下,机械搅拌绝热容器中的液体,使其温度上升,则ΔH= Qp= 0。
3、若一个过程是可逆过程,则该过程中的每一步都是可逆的。
4、理想气体做节流膨胀后温度不变。
5、在298 K时,石墨C(s)的标准摩尔燃烧焓等于CO2(g)的标准摩尔生成焓。
6、气体标准态,规定为处于298 K、100 kPa时纯理想气体的状态。
7、实际气体经绝热自由膨胀后,因Q=0, W=0,所以ΔU=0,气体温度不变。
8、一定量的理想气体,当热力学能与温度确定之后,则所有的状态函数也完全确定。
9、反应C2H4(g) + H2(g)==C2H6(g)的焓变等于生成物的键焓之和减去反应物的键焓之和。
10、在101.325 kPa下,1 mol 100 ℃的水恒温蒸发为100 ℃的水蒸气。若水蒸气可视为理想气体,由于过程等温,所以该过程ΔU=0。
三、单项选择题(下列各题的4个选项中,只有1个正确答案)
1、某封闭系统经历等压过程,功的表示式为
A、![]() B、
B、![]() C、
C、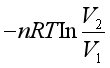 D、
D、![]()
2、实际气体在绝热条件下向真空膨胀过程,下列答案中不正确的是
A、![]() = 0 B、
= 0 B、![]() = 0 C、
= 0 C、![]() = 0 D、
= 0 D、![]() = 0
= 0
3、1mol理想气体在等温下,由压力100 kPa经恒外压1000 kPa压缩至平衡的终态,则
A、![]() =0,
=0, ![]() >0,
>0, ![]() >0 B、
>0 B、![]() <0,
<0, ![]() <0,
<0, ![]() =0
=0
C、![]() >0,
>0, ![]() <0,
<0, ![]() <0 D、
<0 D、![]() <0,
<0, ![]() >0,
>0, ![]() =0
=0
4、某气体状态方程式为![]() (b>0),1mol该气体经绝热向真空膨胀后,气体的温度
(b>0),1mol该气体经绝热向真空膨胀后,气体的温度
A、上升 B、下降 C、不变 D、先升后降
5、某系统经不可逆循环后,下列答案中不正确的是
A、![]() =0 B、
=0 B、![]() =0 C、
=0 C、![]() =0 D、
=0 D、![]() =0
=0
6、A、B两种理想气体在绝热恒容容器中发生化学反应后,系统的温度升高、压力增大,则其热力学能和焓的变化为
A、![]() =0,
=0,![]() =0 B、
=0 B、![]() >0,
>0,![]() >0
>0
C、![]() =0,
=0,![]() >0 D、
>0 D、![]() <0,
<0,![]() <0
<0
7、1 mol理想气体从相同的始态出发,分别经等温可逆膨胀和绝热可逆膨胀,至相同的终态体积V2。所做功的绝对值分别为x和y,则
A、x>y B、x<y C、x=y D、无法比较大小
8、某化学反应在烧杯中进行,Qp=2000 J。若设计在电池中进行,该系统做电功800 J。若两过程的始、终态相同,而且忽略体积功,电池反应的反应热Q为
A、﹣1200 J B、1200 J C、﹣2800 J D、2800 J
9、实际气体节流膨胀过程,Q=0、![]() =0,而且
=0,而且
A、![]() >0,
>0,![]() >0 B、
>0 B、![]() >0,
>0,![]() <0
<0
C、![]() >0,
>0,![]() =0 D、
=0 D、![]() <0,
<0,![]()
![]() 0
0
10、H2(g)的标准摩尔燃烧焓与下列哪一物质的标准摩尔生成焓数值相等
A、H2O(g) B、H2O(l) C、H2O(s) D、都不是

