当前位置:课程学习>>第二章 热力学第二定律>>知识讲解>>视频课堂>>知识点四
知识点四:熵变的计算
一、相变化
1、可逆相变
可逆相变既是在平衡温度和压力下的相变。因为过程是等温等压可逆(且无其他功),则Qp=ΔH=QR
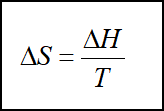
【例题】计算冰在1mol冰在273K,![]() 下熔化为水的熵变。已知冰的熔化焓为6004J·mol-1。
下熔化为水的熵变。已知冰的熔化焓为6004J·mol-1。
解: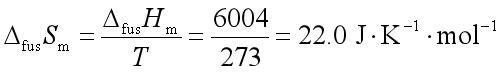
2、不可逆相变
即非平衡温度和压力下的相变,设计可逆途径(通常是等压变温)。
【例题】268.2 K和![]() 的1mol过冷苯凝固为固体苯,求此过程中的熵变。已知苯的熔点为278.7K。
的1mol过冷苯凝固为固体苯,求此过程中的熵变。已知苯的熔点为278.7K。
解:
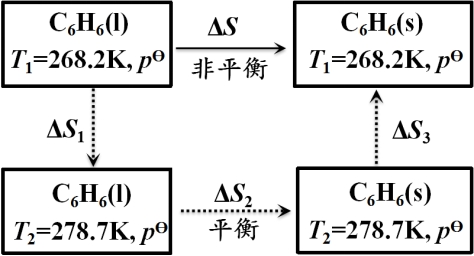
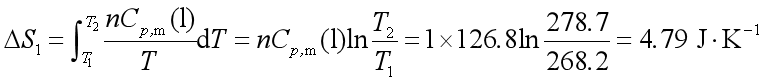
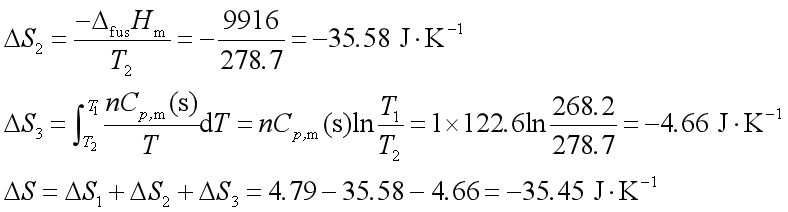
因苯在268.2 K 时的熔化焓为9874 J·mol-1 ,所以热源的熵变为:
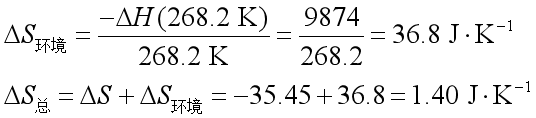
所以此过程是一个自发的不可逆过程。
二、化学反应
等温等压下的化学反应:
1、可逆电池法:
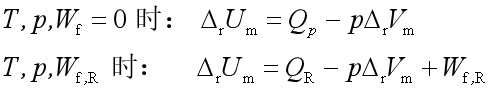
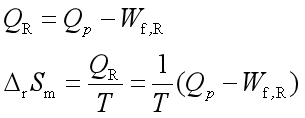
2、间接计算:由已知温度下的熵变![]() 求得
求得
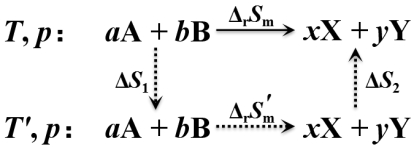
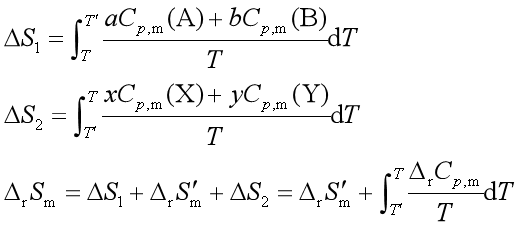
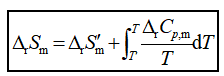
若在T和T′之间出现相变时,应分段计算![]() 和
和![]() 并考虑其中的相变熵。
并考虑其中的相变熵。
接下来让我们进行下一部分的学习
