第二章 热力学第二定律
 知识点一:热力学第二定律的经典表述
知识点一:热力学第二定律的经典表述
一、自发变化与非自发变化
自发变化是指能够自动发生的变化,即无需依靠外来作用就可以发生的变化。或者说,自发变化是指不需要消耗环境作功就能发生的变化。例如,热由高温物体传入低温物体,直至两物体的温度相等;气体由压力高处向压力低处扩散,直至各处压力相等;锌片投入硫酸铜溶液中会发生置换反应,直至达到化学平衡;这些变化都是自发变化。经验告诉我们,自发变化总是单向地趋于平衡,不能自动逆转。如:热不能自动从低温物体流向高温物体;气体不能自动由压力低处向压力高处聚集;金属铜投入硫酸锌溶液中不能自动发生置换反应。也就是说,自发变化的逆向变化不能自动发生,我们称之为非自发变化。
自发变化的共同特征是单向趋于平衡,不能自动逆转,但并不是说它们根本不可能逆转,借助于外力可以使一个自发变化逆向进行。例如,气体向真空膨胀是一个自发变化,该变化自动进行时,![]() ,
,![]() ,
,![]() ,系统的状态改变了。若借助外力压缩活塞,能使气体恢复原来状态,即实现了逆向变化,但结果
,系统的状态改变了。若借助外力压缩活塞,能使气体恢复原来状态,即实现了逆向变化,但结果![]() ,
,![]() ,环境付出了功,得到了热,发生了功转变为热的变化。要使环境也回复到原来的状态,则必须从单一热源取出热量,使之全部转变为压缩活塞的功,这样系统和环境才都回到原来的状态,但经验证明这是不可能的。
,环境付出了功,得到了热,发生了功转变为热的变化。要使环境也回复到原来的状态,则必须从单一热源取出热量,使之全部转变为压缩活塞的功,这样系统和环境才都回到原来的状态,但经验证明这是不可能的。
原则上说,可以由任何的自发变化获得可利用的功,而任何非自发变化的发生,都必须依靠环境对系统作功,这是自发变化与非自发变化的根本区别。例如,在热由高温物体传到低温物体的过程中,可以带动热机作功;一个自发的化学反应可以安排成电池反应作出电功。而在致冷机中,通过对“工作流体”做功,可以使热从低温物体传到高温物体;对某些非自发变化的化学反应,可以对系统作电功使其逆转(电解)。由于从自发变化中可以获得功,所以系统发生自发变化时将失去一些作功的能力;由于非自发变化进行时需要消耗环境的功,所以系统发生非自发变化时,能够获得一定的作功能力。显然,非自发变化发生时,环境消耗的功只能由其他的自发变化所提供。因此,一个自发变化只有在被其他自发变化以某种方式作功推动时,才可能逆向进行。
二、变化的方向性和过程的可逆性
热力学第二定律的基本任务是要解决判断一个变化方向性的依据, 我们在学习热力学时也会经常提到变化方向及过程可逆与否的问题。为此,必须弄清变化方向性及过程可逆性的含义。
“变化”是指系统状态的改变,即系统在不同的时刻存在不同的状态。变化的方向性应该是在指定的始、终两态之间,变化向哪个方向自动进行,即自发变化的方向。显然,变化的方向性取决于系统的始、终两态。
“过程”是完成变化的方式,一个变化发生时,可能以可逆的方式,也可能以不可逆的方式进行,这取决于对过程的具体安排。
例如,某一温度下的气体,始态压力为10![]() , 终态为
, 终态为![]() ,则始、终态之间存在一自发变化。若任其自由膨胀,就是不可逆过程,W =0,
,则始、终态之间存在一自发变化。若任其自由膨胀,就是不可逆过程,W =0,![]() 不作功;若控制在外压为
不作功;若控制在外压为![]() 下膨胀,仍是不可逆过程,但作功
下膨胀,仍是不可逆过程,但作功![]() ;若保持外压始终比系统压力低一无限小量,就成为可逆过程,并作最大功,WR=
;若保持外压始终比系统压力低一无限小量,就成为可逆过程,并作最大功,WR=![]() 。又如,在298K,
。又如,在298K,![]() 下,反应
下,反应
Zn(s) +CuSO4(0.01mol·kg-1) ![]() Cu(s)+ZnSO4(0.01mol·kg-1)
Cu(s)+ZnSO4(0.01mol·kg-1)
始、终态间存在一自发变化。反应直接进行时,是一个不作电功的不可逆过程;若安排成一可逆电池,则反应以可逆方式完成,为一可逆过程,并作出最大电功。
可见,自发变化可以不可逆进行,也可以可逆进行;可以不作功,也可以被利用来作功甚至作最大功。但无论以何种方式进行,都不会影响变化的自发性。
非自发变化的进行,必须依靠环境对系统作功,但也可以以可逆和不可逆两种方式进行。上述两个变化的逆向变化就是如此。气体的压缩依靠外压,若外压逐渐增大,且始终比系统压力大一无限小量,则过程可逆进行,环境作最小功。否则,过程就不可逆进行,环境作出多余的功,并转化为热;Cu与ZnSO4溶液的反应可以通过电解的方式完成,若外加电压比可逆分解电压高无限小,则电流I→0,电解可逆进行,环境消耗最小功。否则,电解就不可逆地进行,环境作出多余的电功,并转化为热。
综上所述,变化是否自发,取决于系统的始、终两态,过程是否可逆,取决于对过程的具体安排,不论是自发变化还是非自发变化,实际进行时是不可逆过程,若施以适当的控制,在理论上能使它们成为可逆过程。
三、热力学第二定律的经典表述
自然界中存在着许许多多的自发变化,它们的共同特征是单向地趋于平衡,并且不可能自动逆向进行。尽管自发变化的逆向变化并不违反热力学第一定律,但却不能自动发生。
各种自发变化看似各不相干,但实际上却互相关联,从某个自发变化的逆向变化不能自动发生可以推断出另一个自发变化也不能自动逆转。人们根据长期积累的经验总结出反映同一客观规律的几种简便说法,即用某种自发变化的不能自动逆转来概括其它自发变化的不能自动逆转。这样一个普遍原理就是热力学第二定律。这里叙述克劳修斯和开尔文两种表述,其中的每一种说法都与自然界中发生的具体现象相联系。
克劳修斯说法:“不可能把热从低温物体传到高温物体,而不引起其他变化。”
开尔文说法:“不可能从单一热源取出热使之完全变为功,而不引起其他变化。”
以上两种说法都是指某一事件是“不可能”的,即指出某种自发变化的逆变化是不可能自动进行的,克劳修斯说法指的是热传导,开尔文说法指的是功转变为热。毫无疑问,这两种说法实际上是等效的。
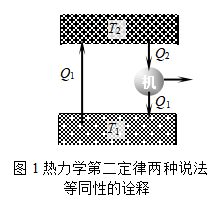
可以用反证法证明热力学第二定律的克劳修斯说法和开尔文说法的一致性(参见图1)。假设克劳修斯说法不成立,即热量Q1能够从温度为T1的低温热源自动地传给温度为T2的高温热源。今使一个卡诺热机在T2和T1间工作,从高温热源吸热Q2(Q2>0),并使其传给低温热源的热恰好等于Q1(Q1<0)。则经过一循环之后,净的结果是卡诺机从单一热源(T2)吸取(Q2+Q1)的热量,全部变为功,而没有其他变化,这违反了开尔文的说法。所以,若克劳修斯说法不成立,则开尔文说法也不成立。反之亦然。
人们把一种能够从单一热源吸热,并使它完全变为功而不引起其他变化的机器称作“第二类永动机”,这种永动机并不违反热力学第一定律,因为它在工作过程中能量是守恒的,但它违反了热力学第二定律的开尔文说法,所以永远造不成。因此,开尔文说法又可以表述为:“第二类永动机是不可能造成的”。倘若第二类永动机能够造成,那么人类就可以无限制地把大气、海洋和陆地中的能量以热的形式提取出来,使其变为功而没有其他变化,可以想象航空和航海就不需要携带燃料了。但事实告诉我们,这是不可能的。
在理解热力学第二定律时有一点需要注意,不要把开尔文的说法简单地说成:“功可以完全转化为热,而热不能完全转化为功。”事实上,不是热不能完全转化为功,而是在不引起其他变化或不产生其他影响的条件下,从单一热源取出的热不能完全转化为功。例如,理想气体在等温膨胀时,所吸收的热完全转化为系统对环境所作的功,但同时发生了系统状态的改变——体积增大了。所以,“不引起其他变化”这一条件是绝对不能忽略的。
热力学第二定律和热力学第一定律一样,都是建立在无数事实的基础上,是人类经验的总结。它不能从任何更普遍的定律推导出来,但整个热力学的发展过程令人信服地表明,它的一切推论都符合客观实际。由此可以肯定,热力学第二定律是一个真实地反映了客观规律的真理。
