一、填空题
1、熵的热力学定义式是![]() ;在封闭系统中,公式
;在封闭系统中,公式![]() 成立的条件是 。
成立的条件是 。
2、热力学第二定律的数学表达式为 ;系统的熵![]() 与其微观状态数
与其微观状态数![]() 的关系(玻耳兹曼公式)为
的关系(玻耳兹曼公式)为![]() ;
;
3、在封闭系统中,气体进行绝热不可逆膨胀时,系统的熵变![]() 0;进行绝热不可逆压缩时,
0;进行绝热不可逆压缩时,![]() 0。
0。
4、熵增加原理可以表述为:“一个 系统的 永不减少”。
5、吉布斯自由能G的定义式为:G= ;亥姆霍兹自由能A的定义式为:A= 。
6、“第二类永动机”是从 热源吸热完全对外做功,而不引起 的机器。
7、热力学基本方程dU= ;’dG= 。
8、作为变化方向和限度的判据,吉布斯自由能判据ΔG的适用条件是: ,亥姆霍兹自由能判据ΔA的适用条件是: 。
9、对应系数关系式,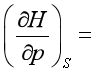 ;麦克斯韦关系式,
;麦克斯韦关系式,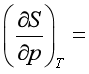 。
。
10、热力学第三定律可以表述为:“在 温度下,任何纯物质 的熵值为零。”
二、判断题(对者写“√”,错者写“×”)
1、封闭系统中的理想气体,经一不可逆循环过程,则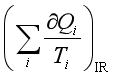 < 0。
< 0。
2、在373 K、101.325 kPa时,H2O(l)变为H2O(g),此变化的ΔA < 0。
3、系统熵增加的过程一定是自发过程。
4、为了计算绝热不可逆过程的熵变,可以在始终态之间设计一条绝热可逆途径来计算。
5、在任意一可逆过程中ΔS=0,不可逆过程中ΔS> 0。
6、理想气体经等温膨胀后,由于ΔU=0,所以吸的热全部转化为功,但这与热力学第二定律并不矛盾。
7、可逆相变过程的熵变可由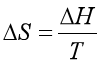 计算。
计算。
8、冰在0 ℃、pƟ下转变为液态水,其熵变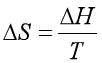 >0,所以该过程为自发过程。
>0,所以该过程为自发过程。
9、吉布斯自由能减小的过程一定是自发过程。
10、在等温、等压下,吉布斯自由能变化大于零的化学变化都不能进行。
三、单项选择题(下列各题的4个选项中,只有1个正确答案)
1、关于热力学第二定律,下列说法不正确的是
A、第二类永动机是不可能造成的
B、热从低温物体传到高温物体,不引起其他变化是不可能的
C、一切实际过程都是热力学不可逆过程
D、功可以全部转为热,但热一定不能全部转化为功
2、系统经一不可逆过程,则
A、![]() B、
B、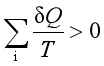
C、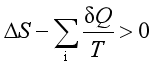 D、
D、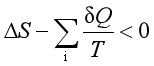
3、气体经绝热不可逆膨胀,熵变![]() ;经绝热不可逆压缩,熵变
;经绝热不可逆压缩,熵变![]() 。则
。则
A、![]() ,
,![]() B、
B、![]() ,
,![]()
C、![]() ,
,![]() D、
D、![]() ,
,![]()
4、在下列变化中,![]() 为负值的是
为负值的是
A、冰融化成水 B、液态水沸腾变成水蒸气
C、电解水生成氢气和氧气 D、![]()
5、有一个化学反应,在低温下可以自发进行,随着温度升高,反应自发倾向降低,则该反应的
A、![]() ,
,![]() B、
B、![]() ,
,![]()
C、![]() ,
,![]() D、
D、![]() ,
,![]()
6、对于熵增加原理,下列表述错误的是
A、隔离系统的熵永不减少
B、在绝热过程中,系统的熵永不减少
C、在不可逆过程中,系统的熵总是增加的
D、隔离系统和绝热系统中不会发生熵减少的过程
7、在下列过程中,定压下升高温度时,![]() 增加的是
增加的是
A、![]()
B、![]()
C、![]() 溶于水
溶于水
D、![]() 与
与![]() 的混合
的混合
8、在下列各式中,正确的是
A、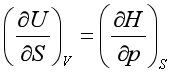 B、
B、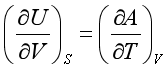
C、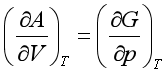 D、
D、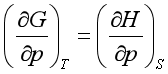
9、某化学反应在300![]() 、
、![]() 下于烧杯中进行,放热60
下于烧杯中进行,放热60![]() ,若在相同条件下安排在可逆电池中进行,吸热6
,若在相同条件下安排在可逆电池中进行,吸热6![]() ,则该反应在300K的
,则该反应在300K的![]() 为
为
A、-66![]() B、-54
B、-54![]() C、66
C、66![]() D、54
D、54![]()
10、恒温下,某理想气体从状态1膨胀至状态2,则此过程的![]() 与
与![]() 的关系为
的关系为
A、![]() B、
B、![]() C、
C、![]() D、无确定关系
D、无确定关系

