引言:
热力学第一定律只说明了当一种形式的能量转变为另一种形式的能量时,总能量是守恒的,但不能回答为什么许多并不违反热力学第一定律的变化,却未能自动发生。例如温度不同的两个物体相接触,最后达到平衡态,两物体具有相同的温度。但其逆过程是不可能的,即具有相同温度的两个物体,不会自动回到温度不同的状态,尽管该逆过程不违背热力学第一定律。又如,气体膨胀进入真空,其逆向变化却不会自动发生。还有,反应:
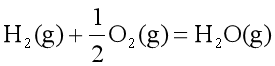
热力学第一定律只能指出正向反应的![]() 和逆向反应的
和逆向反应的![]() 数值相等而符号相反,但不能预言在指定条件下反应自动进行的方向以及能达到的限度。
数值相等而符号相反,但不能预言在指定条件下反应自动进行的方向以及能达到的限度。
解决变化的方向性和限度是热力学第二定律的任务,热力第二定律引进了熵函数(S)和两个辅助热力学函数——亥姆霍兹自由能(A)和吉布斯自由能(G),并作为在特定条件下预测过程的方向和限度的判据。热力学第二定律和热力学第一定律一样,是建立在无数事实基础上的人类经验的总结,虽然不能从更普遍的原理导出,但它的所有推论与事实完全符合,无一例外,其正确性无庸置疑。
热力学第二定律是随着蒸汽机的发明、应用及热机效率等理论研究逐步发展、完善并建立起来的。卡诺(Carnot)、克劳修斯(Clausius)、开尔文(Kelvin)等人在热力学第二定律的建立过程中做出了重要贡献。
热力学第二定律是对于指导工业生产、开发新的工艺路线等具有重要的意义。例如开发一新的工艺路线时,首先应对其热力学可能性进行判断,若通过热力学计算证明其从热力学上根本是不可能的,则就没有必要去研究与开发了。
最后须指出,热力学第二定律只是判断某一变化发生的可能性,而不能肯定在一定的时间内一定会发生该变化。例如热力学第二定律可以断言氢氧混合有生成水的倾向,其实一点火星就足以引起一定比例的氢氧混合物的爆炸。但在无明火或催化剂存在的情况下,氢氧混合物仍能在常温下长时间不发生可觉察的反应。其原因是反应速率问题,而热力学不考虑时间因素。
知识框架:


