问题一:下列说法正确吗?
(1)自然界发生的过程一定是不可逆过程。
(2)自然界发生的过程一定是自发过程。
(3)不可逆过程一定是自发过程。
回答:
(1)正确。自然界发生的过程都是以一定速率进行的,因此都是不可逆的。
(2)错误。自然界发生的过程不一定都是自发的,例如人们用电解水法制备氢气。
(3)错误。也存在不可逆的非自发过程,例如,理想气体绝热不可逆压缩,是不可逆过程也是非自发的。
问题二:自发过程与非自发过程的区别是什么?举例说明自发过程是否可以加以控制,并使它可逆进行?一旦受到控制,是否仍是自发过程?为什么?
回答:
自发过程与非自发过程的区别是:由自发过程可以获得利用的功,即自发过程具有向外做功的能力,而非自发过程的发生,必须依靠环境对系统做功。自发过程可以加以控制,并使它以可逆方式进行,例如Zn(s)+CuSO4(ag)==Cu(s)+ ZnSO4(ag)是一个自发过程,在烧杯中进行是不可逆的,但若放在可逆的丹尼尔电池中进行,就能以可逆方式进行该反应放在可逆电池中以可逆方式进行时,仍然是自发过程,因为它具有对外做功的能力,并不因进行方式而改变,自发过程的方向取决于系统的始终态,与进行的方式无关。
问题三:自发过程和非自发过程的根本区别是什么?什么条件下,它们与过程的可逆与否才有联系?
回答:
根本区别在于能向外界提供功,能向外界提供功是自发过程,需要外界提供功才发生的是非自发过程,在孤立系统中或自然界实际过程中,过程方向性才与过程可逆与否有联系,孤立系统中发生的过程都是自发的,也是不可逆的;自然界实际过程中都是自发不可逆的,如小苗成长大树,是自发的不可逆的,而如电解食盐水制备氯气,是非自发不可逆的。
问题四:为什么热力学第二定律也可表达为:“一切实际过程都是热力学不可逆的”?
回答:
热力学第二定律的经典表述,实际上涉及的是热与功转化的不可逆性,即功能无条件全部转化成热,但热不能无条件全部转化成功,一切实际过程都是不可逆的,实际过程的不可逆性都与热功转化相关联,如果热与功的转化是可逆的,那么所有的实际过程发生后都不会留下痕迹,那也成为可逆的了,这样便推翻了热力学第二定律,也否定了热功转化的不可逆性,则“实际过程都是不可逆的”也不成立。因而也可用“一切实际过程都是不可逆的”来表述热力学第二定律。
问题五:为什么热和功的转换是不可逆的?
回答:
虽然热和功都是能量传递的形式,而且是可以相互转换的,但这种转换并不是等价的。系统经过一个循环,从单一热源吸取的热量不能全部无条件地转换为功;但功可以全部无条件地转换为热,此称热功转换的不可逆性,功是能量传递的高级运动形式,它是序能,是系统中所有微观粒子同时发生定向运动时才能传递给环境的能量形式。热是能的低级运动形式,它是无序能,是通过系统与环境的微观粒子的无规则运动,发生碰撞递的能量形式。所以,有序能可以无条件地全部转变为无序能,但无序能全部转变为有序能却是有条件的——会给环境留下影响,因而热和功的转换是不可逆的。
问题六:“一切自发变化的熵总是增加的。”这句话是否完整?
回答:
不完整。正确的说法是“孤立系统或绝热系统中一切自发变化的熵总是增加的。”
问题七:“可逆过程中系统的熵不变,不可逆过程的熵增大。”这种说法对吗?
回答:
不对。正确的说法是:“绝热系统或孤立系统中,可逆过程中系统的熵不变,不可逆过程的嫡增大。”
问题八:“因为熵是状态函数,所以熵变与过程无关,因而绝热不可逆过程与绝热可逆过程的熵变应该相等。”这种说法对吗?为什么?
回答:
不对。因为从同一始态出发,经绝热不可逆过程与绝热可逆过程不能达到相同的终态。终态不同,两个过程的熵变当然不相等,绝热可逆过程中系统的熵变等于零,绝热不可逆过程中系统的熵变大于零。
问题九:有些教材上说:“用熵增加原理来判断自发变化的方向性和限度,必须是隔离系统,对于把环境包括在内的大隔离系统的总熵计算时,必须同时考虑环境的熵变,这很不方便。因此要在某些特定的条件下,引进一些新状态函数,以便仅依靠系统自身的此种函数的变化值来判断自发变化的方向和限度,而不必再考虑环境的问题了。”你认为这段话有问题吗?
回答:
有些问题的,不完全确切。这里说的大隔离系统是指把系统与环境包括在一起的大隔离系统,是用总熵来判断封闭体系自发变化方向而采取的方法,与热力学中真正的隔离体系是有区别的,它把原环境变成大隔离系统的一部分,把原环境的一些性质变成系统性质,扩大了研究对象,总熵判断并不是因为考虑环境的熵变方便与否的问题,而是总熵判据不加限制条件只能判断过程性质,不能对原封闭系统的自发过程方向与限度作出正确的判据,总熵判据有片面性。
问题十:以下这些说法是否正确?为什么?
(1)因为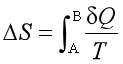 ,所以只有可逆过程才有熵变;而
,所以只有可逆过程才有熵变;而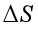 >
>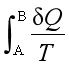 ,所以不可逆过程只有热温商,没有熵变。
,所以不可逆过程只有热温商,没有熵变。
(2)因为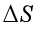 >
>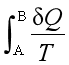 ,所以系统由初态A经不同的不可逆过程到达终态B,其熵的变化值各不相同。
,所以系统由初态A经不同的不可逆过程到达终态B,其熵的变化值各不相同。
(3)因为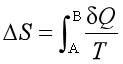 ,所以只要初、终态一定,过程的热温商的值就是一定的,因而ΔS是一定的。
,所以只要初、终态一定,过程的热温商的值就是一定的,因而ΔS是一定的。
回答:
(1)错误。熵是状态函数,无论是可逆过程还是不可逆过程都存在熵变,对于热温商,无论过程可逆与否,只要系统与环境之间存在热交换,就有热温商。
(2)错误。因为熵是状态函数,不论过程可逆与否,只要始终态确定,其变化值是定值,与过程可逆与否无关。
(3)错误。把热温商与状态函数熵改变量混为一谈,这是两个不同概念,只有在可逆过程中,两者在数值上才相等,但物理意义不同。始终态一定,热温商可以是因途径不同而不同,而状态函数熵的改变值ΔS是一定的。
问题十一:有人说:“任意可逆过程中ΔS=0,任意不可逆过程中ΔS>0。”正确吗?
回答:
错误。该说法只有对绝热系统或孤立系统才正确。一般封闭系统就不一定正确。例如理想气体等温可逆膨胀,是可逆过程,但熵增加ΔS>0。而理想气体等温压缩,是不可逆过程,但熵减少ΔS<0。
问题十二:一定量理想气体从某一始态出发,分别经等温可逆膨胀和等温不可逆膨胀,能否达到同一终态?若分别经绝热可逆膨胀与绝热不可逆膨胀,能否达到同一终态?为什么?
回答:
一定量理想气体从某一始态出发,分别经等温可逆膨胀和等温不可逆膨胀,可以达到同一终态。因为分别经等温可逆膨胀和等温不可逆膨胀,系统温度不变,热力学能保持不变,由于热力学能U是状态函数,热力学能U相同,状态就可能相同,因此可以达到同一终态。
理想气体从某一始态出发,分别经绝热可逆膨胀和绝热不可逆膨胀,不能达到同一个终态。因为理想气体经绝热可逆膨胀过程,系统的熵值不变,ΔS=0。而经绝热不可逆膨胀过程,系统的熵值增加,ΔS>0。由于熵S是状态函数,两个终态的熵值不同,状态不同,因此不能达到同一个终态。
问题十三:系统经绝热不可逆过程由状态A变到状态B之后,能否经绝热可逆或绝热不可逆过程使系统由状态B回到状态A而完成一次循环?为什么?
回答:
经绝热可逆过程是不可能完成这样一次循环,因为系统经绝热不可逆过程由状态A变到状态B,系统的熵值增加,即SB>SA;若想要从B态经绝热可逆回到A态,由于绝热可逆过程,熵值不变,即SB不改变,不减少,熵值不能降低为SA值,状态就回不到状态A;同样经绝热不可逆过程也是不能完成循环的,因为从B态经不绝热可逆过程,熵值增加,即SB继续增大,比原来的A态的SA更大,熵值不能降低到A态的SA值,状态就回不到状态A。

