知识点二:化学势
一、化学势与温度和压力的关系
1、与温度的关系
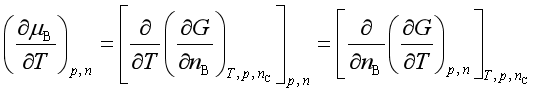
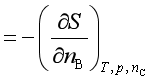
![]()
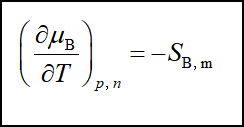
2、与压力的关系
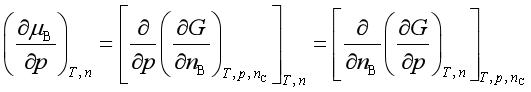
=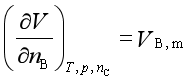
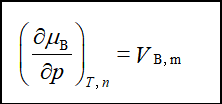
各组分化学势之间的关系:
(1)集合公式
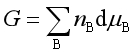
(2)吉布斯——杜亥姆公式
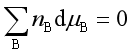
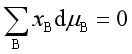
【例题】证明: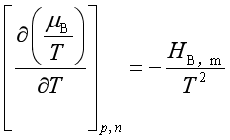
证: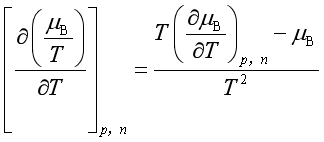
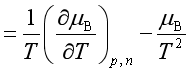
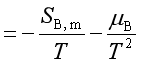
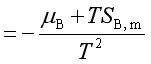
又因 ![]()
定温定压下 ,对nB 求微商,得
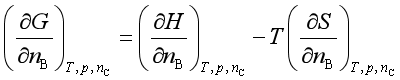
即 ![]()
所以 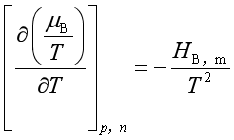
可见,多组分系统的热力学关系式与单组分系统的热力学关系式相比,形式上完全相同,所不同的是用偏摩尔量代替相应的摩尔量。
例如: ![]()
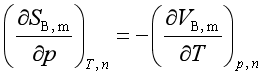
二、化学势判据
引入化学势后,对组成可变的多组分均相系统,四个热力学基本方程变为:
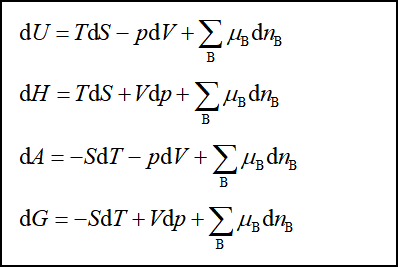
由热力学第二定律可知,在不同条件下变化方向和限度的判据分别为
因此在上述各特定条件下,变化方向和限度的判据均表示为:
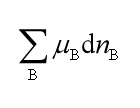

思考题
-
化学势作为变化方向性判据的使用条件?
化学势的物理意义:
(1)在上述各特定条件下进行的过程,必不是简单的状态变化,只能是相变、化学反应、溶解、混合等,而这些过程都伴随着物质的转移。因此可以说,物质的化学势是决定物质传递方向和限度的强度性质。
(2)
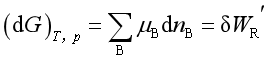 。因此
。因此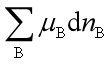 是在上述各条件下,一多组分均相系统在发生状态变化时,能作出最大非体积功的能力。而
是在上述各条件下,一多组分均相系统在发生状态变化时,能作出最大非体积功的能力。而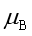 则是单位物质的量变化时所引起系统作非体积功能力的改变。
则是单位物质的量变化时所引起系统作非体积功能力的改变。
综上所述,化学势是从各种判据中抽象出来的一种强度因素,是研究多组分系统的重要热力学量,从本质上说,它代表了传质和进行化学反应的一种“位势”,类比于“水位”和“电势”等。
接下来让我们进行下一部分的学习
