第三章 多组分系统热力学
 知识点二:化学势
知识点二:化学势
一、化学势的定义
为讨论多组分系统中的热力学关系式和判断反应进行方向,引入一个重要的概念——化学势。
设有k个组分的均相封闭系统,其吉布斯函数应为![]() 的函数,若这些量发生改变,则
的函数,若这些量发生改变,则
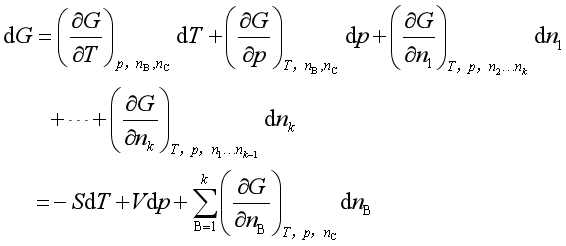
上式中下角标![]() 表示任一组分B的物质的量,
表示任一组分B的物质的量,![]() 表示除组分B之外的其余组分的物质的量。定义B组分的化学势
表示除组分B之外的其余组分的物质的量。定义B组分的化学势
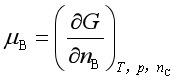 (6)
(6)
则
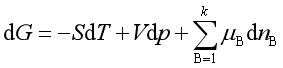 (7)
(7)
显然![]() ,化学势等于偏摩尔吉布斯自由能。
,化学势等于偏摩尔吉布斯自由能。
由关系式
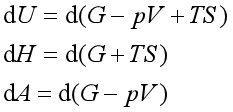
将其代入式(7),并整理后得到均相多组分封闭系统的热力学公式,即
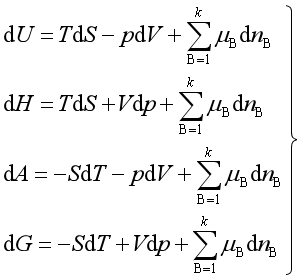 (8)
(8)
由式(8)不难得到
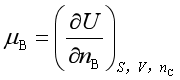 ;
;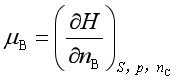 ;
;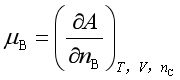
以上三式也是化学势的表达式,可以通过热力学关系式证明彼此是相等的。可见,加上式(6),化学势共有四种表达式。在![]() 的表达式中,以
的表达式中,以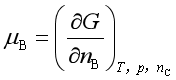 用得最多,因为实际过程大多在等温等压下进行,所以本书用化学势讨论问题时,若不指明,均指
用得最多,因为实际过程大多在等温等压下进行,所以本书用化学势讨论问题时,若不指明,均指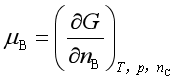 。并应注意,这里化学势只是偏摩尔吉布斯自由能,而不是其它偏摩尔量。对于纯物质,化学势等于摩尔吉布斯自由能,即
。并应注意,这里化学势只是偏摩尔吉布斯自由能,而不是其它偏摩尔量。对于纯物质,化学势等于摩尔吉布斯自由能,即![]() (*表示纯态)。
(*表示纯态)。
二、化学势与温度和压力的关系
1.与温度的关系
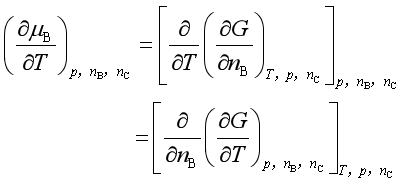
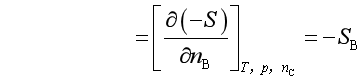 (9)
(9)
这与纯物中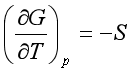 相似,只是用偏摩尔量代替了相应的摩尔量。
相似,只是用偏摩尔量代替了相应的摩尔量。
2. 与压力的关系
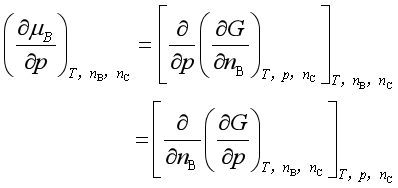
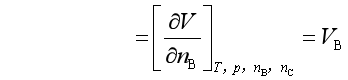 (10)
(10)
这也与纯物中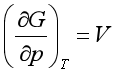 相似。
相似。
由以上推导可见,多组分系统中的热力学公式与纯物质的热力学公式具有相同的形式,只是将纯物质公式中的摩尔量换成偏摩尔量即可。绝少数例外情况,这里不再叙述。
三、化学势与相平衡
设系统由![]() 和
和![]() 相组成,两相均有多个组分。在等温等压下,有微量的B组分dnB从
相组成,两相均有多个组分。在等温等压下,有微量的B组分dnB从![]() 相向
相向![]() 相转移,系统的吉布斯函数改变为
相转移,系统的吉布斯函数改变为
因为
所以
众所周知,上式中,若![]() ,表示系统达到平衡。因
,表示系统达到平衡。因![]() >0,故
>0,故![]() 。说明物质B在两相中达到平衡的条件是它在两相中的化学势相等。
。说明物质B在两相中达到平衡的条件是它在两相中的化学势相等。
若上述的转移过程是自发进行的,则![]() <0或
<0或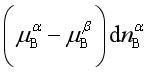 <0,所以
<0,所以![]() <
<![]() 。这说明物质B自发转移的方向是从高化学势相向低化学势相进行,直到B在两相中化学势相等为止。
。这说明物质B自发转移的方向是从高化学势相向低化学势相进行,直到B在两相中化学势相等为止。
例2 试比较和论证下列四种状态纯水的化学势大小顺序:
(1)373.15K,101325Pa液态水的化学势 ![]() 1;
1;
(2)373.15K,101325Pa水蒸气的化学势 ![]() 2;
2;
(3)373.15K,202650Pa液态水的化学势 ![]() 3;
3;
(4)373.15K,202650Pa水蒸气的化学势 ![]() 4。
4。
解 在水的正常沸点时,气-液两相平衡 μ1=μ2;
在温度为373.15K及202 650 Pa下 μ4>μ3 。
因为  >0
>0
所以 μ3>μ1
μ4>μ2
故 μ4>μ3>μ2=μ1。
有关化学势在化学反应中的应用将在第五章中讨论。
