第三章 多组分系统热力学
 知识点六:理想稀溶液
知识点六:理想稀溶液
一、理想稀溶液定义
在一定的温度下,溶剂和溶质形成溶液时,若在一定浓度范围内,溶剂遵守拉乌尔定律,溶质遵守亨利定律,则此浓度范围内的溶液就是理想稀溶液。
在热力学上,“稀溶液”并没有一个浓度数值来规定,当溶剂不遵守拉乌尔定律,溶质不遵守亨利定律时,即使溶液浓度很低,也不能称为稀溶液。可见,不同种类的稀溶液,其浓度范围是不相同的。
二、理想稀溶液中各组分的化学势及标准态
1. 溶剂的化学势
现以二元溶液为例来讨论。设A为溶剂,B为溶质。
按照理想稀溶液的定义,溶剂遵守拉乌尔定律,故理想稀溶液中溶剂的化学势与理想液态混合物中任一组分化学势的表达式(28),(31)一样,即
![]() (36a)
(36a)
或
![]() (36b)
(36b)
溶剂的标准态是指定温度、压力为![]() 且服从拉乌尔定律的纯液态溶剂(
且服从拉乌尔定律的纯液态溶剂(![]() )。这是一个真实存在的状态。
)。这是一个真实存在的状态。
2.溶质的化学势
与溶液中溶质浓度的不同表示形式(质量摩尔浓度、摩尔分数浓度和物质的量浓度)相对应,稀溶液的亨利定律有三种不同的表达式(式23)。由于理想稀溶液中的溶质服从亨利定律,所以,溶质化学势的表达式及标准态也有不同的形式。
对于溶液中的溶质,平衡时其化学势为
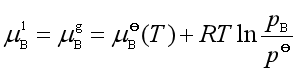 (37)
(37)
若溶液浓度用![]() 表示,将亨利定律
表示,将亨利定律![]() 代入上式,得
代入上式,得
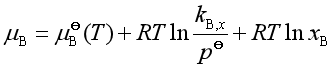 (38)
(38)
将式(38)中等式右边的前两项合并,并令
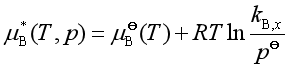 (39)
(39)
将式(39)代入(38)得
![]() (40a)
(40a)
式(40a)就是理想稀溶液中溶质B浓度用摩尔分数表示时化学势的表达式。
显然,![]() 是
是![]() ,且又服从亨利定律那个状态的的化学势,但亨利定律仅在
,且又服从亨利定律那个状态的的化学势,但亨利定律仅在![]() 很小范围才适用,在
很小范围才适用,在![]() 时,溶质的行为已经偏离了亨利定律,所以该状态是一个并不存在的假想态。
时,溶质的行为已经偏离了亨利定律,所以该状态是一个并不存在的假想态。
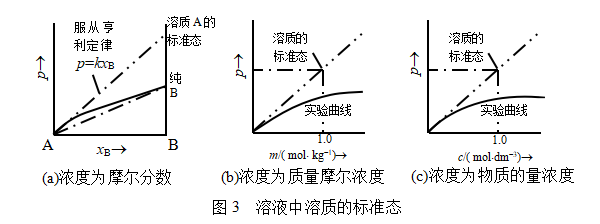
我们选取温度为![]() 、压力为
、压力为![]() ,纯液体B(
,纯液体B(![]() )且服从亨利定律的状态为溶质B的标准态,该标准态显然也是一个假想状态,如图3a所示。设溶质在该标准态的化学势用
)且服从亨利定律的状态为溶质B的标准态,该标准态显然也是一个假想状态,如图3a所示。设溶质在该标准态的化学势用![]() 表示,它与
表示,它与![]() 间的关系为
间的关系为
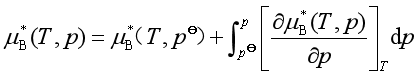
已知
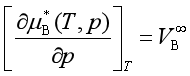
![]() 就是极稀溶液中溶质的偏摩尔体积,代入前式可得
就是极稀溶液中溶质的偏摩尔体积,代入前式可得
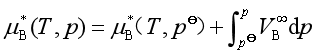
![]() 与
与![]() 相差不大时,
相差不大时,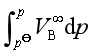 值很小,此时有
值很小,此时有
故又可得理想稀溶液中溶质的化学势为
若溶液浓度用质量摩尔浓度![]() 表示,将亨利定律
表示,将亨利定律![]() 代入式(37),得
代入式(37),得
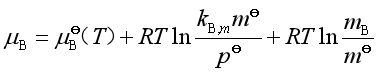
令
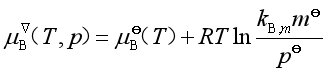 (41)
(41)
得
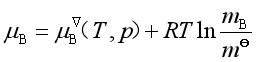 (42a)
(42a)
式(42a)就是溶液浓度用![]() 表示时溶质化学势的表达式。
表示时溶质化学势的表达式。![]() 是溶质在温度T,压力p下,mB =1mol·kg-1,且服从亨利定律这个假想态的化学势。它与同温度,标准压力
是溶质在温度T,压力p下,mB =1mol·kg-1,且服从亨利定律这个假想态的化学势。它与同温度,标准压力![]() 下,
下,![]() =1mol·kg-1又服从亨利定律的溶质标准态的化学势
=1mol·kg-1又服从亨利定律的溶质标准态的化学势![]() 不同,但由于
不同,但由于![]() 与
与![]() 相差不大,故式(42a)也可近似写成
相差不大,故式(42a)也可近似写成
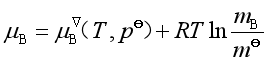 (42b)
(42b)
图3b标出了质量摩尔浓度表示的溶质的标准态,显然,它也是一个假想状态。因为![]() 时,溶质已经偏离了亨利定律。
时,溶质已经偏离了亨利定律。
若溶质的浓度用物质的量的浓度cB表示,用与前面同样的方法,可得
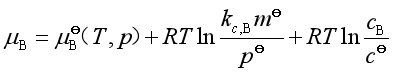
合并等式右方的前两项可得
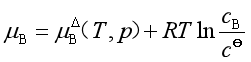 (43a)
(43a)
或
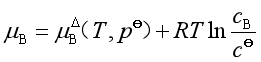 (43b)
(43b)
式中![]() 是理想稀溶液中溶质标准态的化学势。是指温度为
是理想稀溶液中溶质标准态的化学势。是指温度为![]() ,压力为
,压力为![]() 时,当
时,当![]() =1mol·dm-3且服从亨利定律的一个假想态(参阅图3c)。
=1mol·dm-3且服从亨利定律的一个假想态(参阅图3c)。
到此,已经介绍了稀溶液中溶剂和溶质化学势的表达式。有时候,我们把溶剂化学势表达式(36)和溶质化学势的表达式(40)、(42)和(43)叫作理想稀溶液的热力学定义。在理想稀溶液中,溶剂和溶质化学势的表达式形式一样,但标准态的含义是不一样的。其中,溶剂化学势的标准态是真实纯溶剂状态,而溶质的标准态则是假想纯态。
19世纪末,范荷夫等人对稀溶液进行了详细的研究,建立了稀溶液的理论基础。这种理论可以使我们从组成预测溶液的性质。下面介绍稀溶液的性质与其组成之间的关系。
