第三章 多组分系统热力学
 知识点七:稀溶液的依数性
知识点七:稀溶液的依数性
当由非挥发性溶质和挥发性溶剂构成稀溶液时,溶液上方的蒸气压将比同温下纯溶剂的饱和蒸气压低。由于这个原因,溶液的冰点要比相同外压下纯溶剂的冰点低;沸点比相同外压下纯溶剂的沸点高。若将溶液与纯溶剂间用半透膜隔开,纯溶剂就会向溶液那侧“渗透”。这些现象,都只与溶质分子的数量有关而与溶质的本性无关,称之为稀溶液的“依数性”。
一、稀溶液溶蒸气压降低
由于稀溶液中溶质非挥发,故溶液上方的蒸气压就是溶液中溶剂的蒸气压。溶液中溶剂的蒸汽压![]() 低于同温度下纯溶剂的饱和蒸气压
低于同温度下纯溶剂的饱和蒸气压![]() ,这一现象称为溶剂的蒸气压下降。蒸气压下降值为
,这一现象称为溶剂的蒸气压下降。蒸气压下降值为![]() 。根据拉乌尔定律可得
。根据拉乌尔定律可得
即
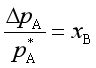 (44)
(44)
上式说明溶剂蒸气压的相对下降值等于溶质的摩尔分数,而与溶质是什么物质无关,故它是稀溶液的依数性之一。利用这个性质可以测定溶质的摩尔质量。
根据稀溶液溶剂化学势的表达式![]() ,因溶剂的摩尔分数
,因溶剂的摩尔分数![]() ,所以溶液中溶剂的化学势小于同温度下纯溶剂的化学势,这就是溶液中溶剂蒸气压下降的根本原因。
,所以溶液中溶剂的化学势小于同温度下纯溶剂的化学势,这就是溶液中溶剂蒸气压下降的根本原因。
例7 设纯净的氨以足够慢的速度通过一个由3.000g不挥发性有机物(2)溶于200g苯(1)中构成溶液后,再通过纯苯。此时得知溶液减轻了2.1540g,同时纯苯减轻了0.0160g。求该有机物质的摩尔质量。
解 由于氨通过很慢,所以足以使苯蒸汽在氨中达到饱和,设等温下苯蒸汽在氨内的分压力为p1,即为苯溶液的蒸汽压。混合气体为理想气体,其体积为V。苯蒸汽质量为W1,苯的摩尔质量M1=78.01×10-3kg·mol-1,则有:
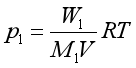
式中,W1=苯溶液失重=2.1540g
同理,混有苯蒸汽的氨再通过纯苯时,混合气体中苯的分压值即为同温下纯苯的饱和蒸汽压![]() ,如果略去混合气体经过纯苯后的体积变化,则:
,如果略去混合气体经过纯苯后的体积变化,则:
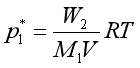
式中,W2=苯溶液失重+纯苯失重=(2.1540+0.0160)g=2.1700g
根据拉乌尔定律![]() ,得:
,得:
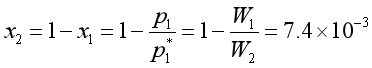
而
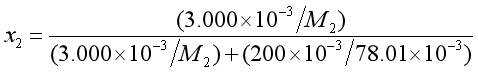
故
二、稀溶液凝固点降低
当溶质与溶剂形成溶液后,在降温冷却过程中会出现两种情况:
(1)溶质与溶剂同时凝固,一起进入固相,形成“固溶体”(固态溶液),达成平衡
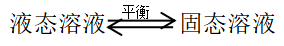
此时,溶液的凝固点可能比纯溶剂低,也可能比纯溶剂高,这种情况,将在第四章中讨论。
(2)溶液冷却凝固时,溶质留在液相中,仅溶剂呈固相析出,达成
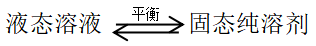
一定外压下,溶液与固态纯溶剂达平衡时的温度,称为稀溶液的凝固点。它低于同一外压下纯溶剂的凝固点,并且只与溶质浓度有关,而与溶质性质无关。应用热力学原理可以推导出凝固点降低值与溶液组成的定量关系。
对于纯溶剂,设一定外压下在其凝固点![]() 时达液-固平衡,两相化学势相等,即
时达液-固平衡,两相化学势相等,即
当在溶剂中加入溶质形成溶液时,凝固点为![]() ,此时溶液中溶剂化学势的改变为
,此时溶液中溶剂化学势的改变为![]()
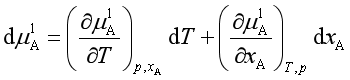
由于凝固点改变而引起固态纯溶剂化学势改变为![]()
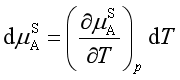
在溶液的凝固点![]() 时,溶液与固体纯溶剂达平衡,两相化学势仍相等,即
时,溶液与固体纯溶剂达平衡,两相化学势仍相等,即
因为
所以
![]() (45)
(45)
即
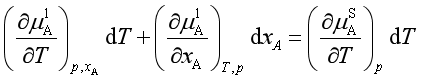
对于稀溶液,![]() ,又已知
,又已知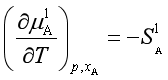 ,
,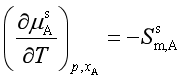 。代入上式,有
。代入上式,有

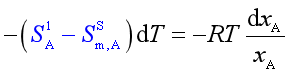 (46)
(46)
上式中,![]() 表示1mol固态纯溶剂进入溶液变成溶剂组分时的熵变,而这是在等温等压条件下可逆地进行的(因为溶液与固态纯溶剂达到平衡),所以有
表示1mol固态纯溶剂进入溶液变成溶剂组分时的熵变,而这是在等温等压条件下可逆地进行的(因为溶液与固态纯溶剂达到平衡),所以有![]() 。即
。即
上式中![]() 是1mol固态纯溶剂变成溶液中溶剂时的焓变,对于稀溶液,可以近似地当作是1mol固态纯溶剂的熔化热
是1mol固态纯溶剂变成溶液中溶剂时的焓变,对于稀溶液,可以近似地当作是1mol固态纯溶剂的熔化热![]() ,
,
所以
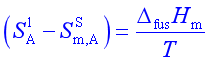
将此结果代入(46),即得
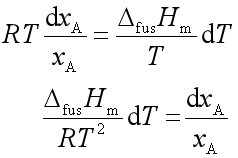
积分上式
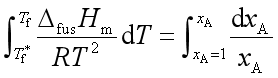
由于凝固点降低值一般不大,所以![]() 可当成常数,上式积分结果
可当成常数,上式积分结果
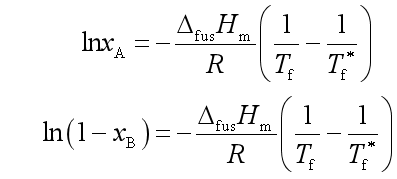
当![]() 很小时,
很小时, 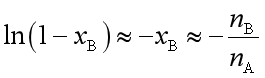 ,则
,则
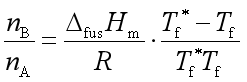
令![]() ,
,![]() 称为稀溶液的凝固点降低值。又因为
称为稀溶液的凝固点降低值。又因为![]()
故
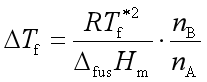 (47)
(47)
在溶液的讨论中,常用质量摩尔浓度来表示溶液组成,
令
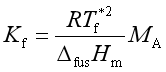 (48)
(48)
式中![]() 为A的摩尔质量,
为A的摩尔质量,![]() 称为质量摩尔凝固点降低系数,简称凝固点降低系数,其数值仅由溶剂本性决定。
称为质量摩尔凝固点降低系数,简称凝固点降低系数,其数值仅由溶剂本性决定。
将式(48)代入(47)得
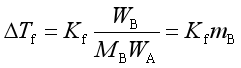 (49)
(49)
这就是稀溶液的凝固点降低公式。由式(49)可知![]() 的单位应是K·kg·mol-1。
的单位应是K·kg·mol-1。
各种常见溶剂的凝固点降低系数列于表1中。
表1 几种溶剂的![]() 值
值
溶剂 |
水 乙酸 苯 环己烷 萘 三溴甲烷 |
|
273.15 289.75 278.65 279.65 353.5 280.95 |
|
1.86 3.9 5.12 20 6.9 14.4 |
稀溶液凝固点降低这个性质,在科研工作中广泛被用来测定未知物的摩尔质量。也可用来鉴定物质的纯度及求物质的熔化焓。在水中加入价廉的氯化钙,氯化钙水溶液的凝固点比纯水低得多,最低可达-55℃,因而在化工生产中广泛地用作为冷却剂。
另外,利用凝固点降低性质,可配制低熔点合金。
稀溶液凝固点降低的公式,虽然是对非挥发性溶质的稀溶液而言,但对溶质是挥发性的稀溶液,公式同样可以使用,因为溶液凝固点的降低是由于溶液中溶剂的化学势比纯溶剂低,并且在整个过程中,我们作了如下假设:(1)溶剂服从拉乌尔定律;(2)![]() 当作常数;(3)
当作常数;(3)![]() 及
及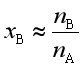 。在这些假设中,完全没有提及溶质必须是非挥发性的要求。
。在这些假设中,完全没有提及溶质必须是非挥发性的要求。
例8 已知樟脑(C10H16O)的凝固点降低系数 kf = 40 K·kg·mol-1。
( 1 ) 某一溶质相对分子质量为210 , 溶于樟脑形成质量分数为wB=0.05的溶液 , 求凝固点降低多少 ?
( 2 ) 另一溶质相对分子质量为9000 , 溶于樟脑形成质量分数为wC=0.05的溶液 , 求凝固点降低多少 ?
解 (1)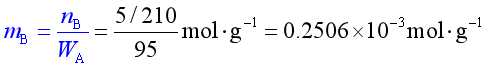
![]()
ΔTf = kf·mB = 40×0.2506K= 10.03 K
(2)
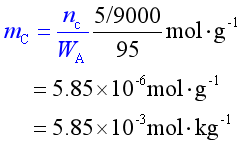
ΔTf = kf·mc = 40×5.85×10-3K= 0.234 K
三、稀溶液沸点升高
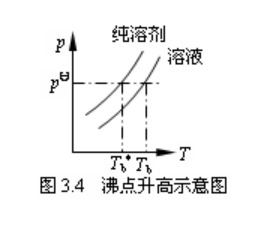
稀溶液的沸点指的是一定外压下,溶液的饱和蒸气压等于外压时的温度。由于溶质是非挥发性的,因此溶液上方的饱和蒸气压指的就是溶剂的饱和蒸气压。因为溶液的饱和蒸气压恒小于同温下纯溶剂的饱和蒸气压,故稀溶液的沸点必然高于纯溶剂的沸点。如图3.4所示。
与推导凝固点降低类似的方法可以推得
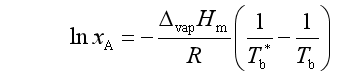
令溶液沸点升高![]() 代入上式,可得
代入上式,可得
![]() (50)
(50)
此式即为沸点升高公式,式中 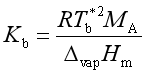 。
。
![]() 称为沸点升高系数,它只与溶剂的性质有关。各常见溶剂的
称为沸点升高系数,它只与溶剂的性质有关。各常见溶剂的![]() 值列在表2中。
值列在表2中。
表2 几种溶剂的![]() 值
值
溶剂 |
水 乙酸 苯 苯酚 萘 四氯化碳 氯仿 |
|
373.15 391.05 353.25 454.15 491.5 349.87 334.35 |
|
0.51 3.07 2.53 5.8 5.8 4.95 3.85 |
稀溶液沸点升高公式只能用于非挥发性溶质,若溶质是挥发性的,溶液的沸点可能低于纯溶剂的沸点。
与凝固点降低公式类似,测定溶液的沸点上升值。可以确定溶质的摩尔质量。
四、渗透现象和渗透压
有许多天然或人造膜对于物质的透过有选择性,如血球的膜允许Na+通过而不允许K+通过,铁氰化铜的膜允许水通过而不允许水中的糖通过,这类膜称为半透膜。现假设一U形等温容器用一半透膜分隔为两部分,此半透膜允许溶剂分子通过而不允许溶质分子通过。半透膜左侧的容器中放有纯溶剂,右侧放有此溶剂与非挥发性溶质形成的稀溶液。整个容器维持恒温,如图5所示。开始时,作用在纯溶剂面上和溶液面上的外压都是![]() ,所以纯溶剂和溶液处于同温
,所以纯溶剂和溶液处于同温![]() ,同外压
,同外压![]() 下。
下。
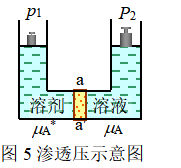
对纯溶剂而言,其化学势是![]()
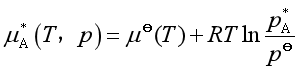
对溶液中溶剂而言,其化学势是![]()
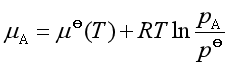
因为![]() >
>![]() ,所以
,所以![]() >
>![]() 。因此,溶剂分子自纯溶剂向溶液中渗透,这种现象,称为渗透现象。
。因此,溶剂分子自纯溶剂向溶液中渗透,这种现象,称为渗透现象。
若维持纯溶剂上方的外压![]() 不变,而使右方溶液面上的外压逐渐增大,由于液体的饱和蒸气压
不变,而使右方溶液面上的外压逐渐增大,由于液体的饱和蒸气压![]() 随外压的增加而增大,故溶液中溶剂的化学势
随外压的增加而增大,故溶液中溶剂的化学势![]() 也随外压的增加而加大。当右方的外压由
也随外压的增加而加大。当右方的外压由![]() 增大到
增大到![]() 时,右方溶液中溶剂的化学势
时,右方溶液中溶剂的化学势![]() 就与左方纯溶剂的化学势
就与左方纯溶剂的化学势![]() 相等,这时渗透就达到动态平衡。此时外加在溶液上方的外压
相等,这时渗透就达到动态平衡。此时外加在溶液上方的外压![]() 与溶剂面上的外压
与溶剂面上的外压![]() 之差,称为渗透压,用
之差,称为渗透压,用![]() 表示
表示
![]() (51)
(51)
所以,渗透压是阻止渗透现象进行而需要外加在溶液面上的额外压力。
由于![]() 的大小与溶液浓度有关,所以渗透压的大小也与溶液浓度有关。
的大小与溶液浓度有关,所以渗透压的大小也与溶液浓度有关。
对纯溶剂而言,一直处于定![]() 定外压
定外压![]() 下,故其化学势一直是
下,故其化学势一直是![]() 。对溶液中的溶剂而言,温度不变,而外压
。对溶液中的溶剂而言,温度不变,而外压![]() 变到
变到![]() ,故相应的化学势也发生改变
,故相应的化学势也发生改变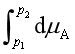 ,此时,渗透达到动态平衡。溶液中溶剂的化学势与纯溶剂的化学势相等。因此
,此时,渗透达到动态平衡。溶液中溶剂的化学势与纯溶剂的化学势相等。因此
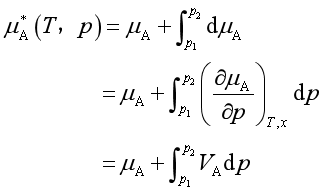
式中![]() 是溶剂的偏摩尔体积,它随压力的变化值很小,可当作定值。故
是溶剂的偏摩尔体积,它随压力的变化值很小,可当作定值。故
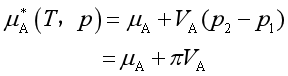
因溶液中溶剂的化学式为![]() ,故上式化为
,故上式化为
因为
所以
或
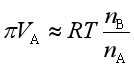
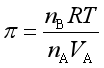 (52)
(52)
对于稀溶液,![]() ,并且
,并且![]() 可近似看成溶液的体积
可近似看成溶液的体积![]() ,则上式变为
,则上式变为
所以
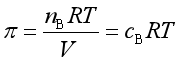 (53)
(53)
这就是渗透压与溶液浓度间的定量关系。
式(53)应用时要求溶质不电离、不缔合,如果溶质在形成溶液时发生离解或缔合,应采用下式
![]() (54)
(54)
如溶质是NaCl,在水溶液中完全电离,则![]() 。又如苯甲酸在苯中形成二聚物,其
。又如苯甲酸在苯中形成二聚物,其![]() 应为
应为![]() 。
。
由式(53)可知,测定渗透压可以确定溶质的摩尔质量,一些大分子物质的摩尔质量通常采用渗透压法测定。
渗透压在工业上也很有用处。例如,目前在处理废水中,用反渗透法使废水中的水渗透出来而成净水以便再使用。其原理是这样的:当纯水与废水以半透膜(只允许水通过)隔开时,在废水一方加大外压,此外压大于纯水与废水之间的渗透压,以致废水中的水反而向纯水相渗透,从而分离了废水,得到了纯水。同样,利用反渗透方法可以从海水中渗透出纯水以制取淡水,供远洋航行船只需要。显然,这一方法对半透膜的要求很高。
渗透作用在生物学上也是很重要的,植物和动物细胞壁起半透膜作用。若细胞外部液体中溶质的浓度大于细胞内部液体的浓度,则细胞将失去液体而收缩。若细胞外部溶质的浓度小于细胞内溶质的浓度,则液体进入细胞,导致细胞破裂,失去血红素,发生所谓的溶血作用。因此,在作静脉滴注时,不能用纯水滴注,而只能用与人体血液渗透压(一般是729.5kPa)相近似的含0.9%(约0.3mol·L-1)NaCl的生理盐水,进行等渗滴注,细胞就不受渗透作用的影响。
例9 海水中含有大量盐,所以在298K时海水的蒸气压为0.306 kPa,同温下纯水的饱和蒸气压是0.3167kPa,计算下述从海水中取出1 molH2O过程所需最小非体积功。
解 海水中的水 → 纯水
![]() =0.306 kPa
=0.306 kPa ![]() =3.167kPa
=3.167kPa
由于![]() ,所以欲求最小非体积功,也就是求上述过程的
,所以欲求最小非体积功,也就是求上述过程的![]()

所以 ![]()
用反渗透法从海水中得到1mol淡水耗功5.790kJ,而用蒸馏法从海水中蒸馏得1mol淡水耗功是41.84kJ,用冷冻法使纯水结冰,得1mol淡水耗功58.58kJ。可见,用反渗透法得淡水在能量上是很经济的,关键在于半透膜必须是高强度的、耐高压且不易堵塞,同时又不让离子透过。
