问题一:物质的偏摩尔量与摩尔量有什么异同点?
回答:
对于单组分系统,只有摩尔量,而没有偏摩尔量,或者说,在单组分系统中,偏摩尔量就等于摩尔量。只有在多组分系统中,各种物质的量也成为系统的变量,当某物质的量发生改变时,就会引起系统的某些广度性质发生改变,由此才引入了偏摩尔量的概念。系统总的广度性质要用偏摩尔量的加和公式计算。而不能用纯的物质的摩尔量乘以物质的量来计算,物质的摩尔量总是大于零,但物质偏摩尔量在一定条件下会小于零,即为负值。
问题二:如果1000 cm水中加入1 mol的H2SO4,溶液的体积增加ΔV,则H2SO4的偏摩尔的数值就是ΔV吗?为什么?
回答:
不是ΔV。这里的ΔV值是溶液变化的体积,不是H2SO4的偏摩尔体积,因为偏摩尔体积的定义是:
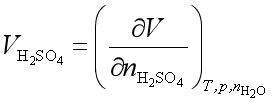
可以理解为无限大量的H2SO4水溶液中,加人1 mol H2SO4所引起溶液体积的变化值ΔV,本题条件不是无限大量系统,因此ΔV不是H2SO4的偏摩尔体积。
问题三:在使用吉布斯—杜亥姆公式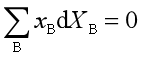 时,是否需要等温、等压的条件?为什么?
时,是否需要等温、等压的条件?为什么?
回答:
需要等温、等压的条件,因为偏摩尔量的定义式就是在等温、等压条件下、组成不变的偏微商,因此吉布斯—杜亥姆公式也只有在等温、等压的条件才成立。
问题四:什么是化学势?它与偏摩尔量有什么区别?
回答:
化学势的广义定义是:保持某热力学函数的两个特征变量和除B以外的其他组分不变时,该热力学函数对B物质的量求偏微商,或者该热力学函数对B物质的量变化率。例如
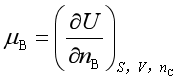 ;
;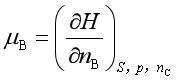 ;
;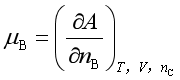 ;
;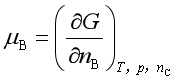
偏摩尔量的定义是在等温等压条件下,保持除B以外的其余组分不变,系统的广度性质X随组分B物质的量的变化率,用X表示系统某个广度性质,其偏摩尔量的定义式为:
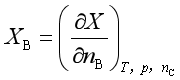
也可以看成在一个等温等压下无限大系统中加入1 mol物质B引起的广度性质X的变化值,因此化学势与偏摩尔量的定义不同,偏微分的下标也可不同,但有一个例外,偏摩尔自由能和化学势是相同的,物理化学中一般的讨论的化学势就是偏摩尔自由能,因此它既是化学势又是偏摩尔量。
问题五:中学化学中配制物质的体积摩尔浓度,要求使用容量瓶,为什么?
回答:
由于溶质溶于溶剂后,溶质与溶剂的状态都发生了变化,摩尔体积变成了偏摩尔体积,溶液的体积不是溶质与溶剂体积的简单加和,例如100 ml水与20ml乙醇混合后的体积就不是120 ml,而是小于120ml,这样溶液(混合物)的体积不好确定,体积摩尔浓度也就不好确定,只有用容量瓶,用溶剂滴加到容量瓶刻度,精确标定了溶液的体积,才好确定溶液的体积摩尔浓度,因此必须用容量瓶。
问题六:在均相多组分系统得出以下的四个基本方程,对多相多组分系统是否适用?
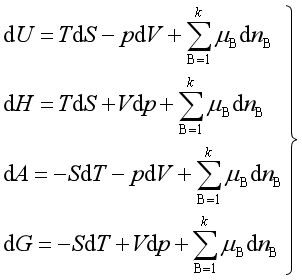
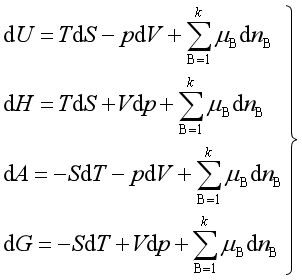
回答:
该四个基本方程虽然是用均相多组分系统(或称单相组成可变系统)得出的,但是如果将不同相态的同一物质视为不同物种,这些方程对多相多组分系统、无非体积功的过程也适用。
问题七:化学势概念的建立解决了什么问题?
回答:
在多组分系统中,每一组分的行为与各组分单独存在时不一样,这种差别所产生的原因是由于不同种类分子间的相互作用与同类分子间的相互作用不同。由此可见,这种差别不仅随组成系统的物质种类不同而异,而且还是浓度的函数热力学不研究微观粒子的行为及相互作用,为了描述多组分系统中每一种物质的实际行为,引进了化学势的概念,化学势是一个宏观量,它将各组分间的所有影响因素都包括在其中了,所以化学势是以实际应用为背景引人的一个概念,有很强的实践性。
问题八:化学势的物理意义是什么?
回答:
以化学势狭义定义式:
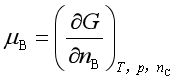
它表示在温度、压力和其他组分的含量不变的条件下,增加1 mol组分B引起系统自由能的变化值,上述定义式的右方称为偏摩尔吉布斯自由能,即在多组分系统中1 mol物质B的实际自由能。
问题九:请比较下列各情况化学势的大小,并简单说明理由?
(1)未饱和糖水溶液中糖的化学势与固体糖。
(2)重结晶过程中析出固体NaCl与母液中NaCl。
(3)过饱和溶液中溶剂的化学势与纯溶剂的化学势。
(4)过饱和溶液中溶质的化学势与纯溶质的化学势。
(5)纯物质过冷液体的化学势与其固体的化学势。
(6)自由水分子与多孔硅表面吸附的水分子。
回答:
(1)未饱和糖水溶液中糖的化学势小于固体糖的化学势。因为未饱和,固体糖有向水溶液中溶解的趋势,即固体糖的化学势大于未饱和糖水溶液中糖的化学势。
(2)重结晶制作过程中,析出固体NaCl的化学势等于母液中NaCl的化学势。因为桥出固体NaCl与母液中NaCl的到达平衡状态。
(3)过饱和溶液中溶剂的化学势小于纯溶剂的化学势,不论溶液是否饱和,溶剂的化学势都小于纯溶剂的化学势,若用一半透膜置于过饱和溶液与纯溶剂之间,纯溶剂会自动向过饱和溶液渗透。
(4)过饱和溶液中溶质化学势大于纯溶质的化学势。因为过饱和溶液是亚稳态,一经搅拌溶质就会自动析出纯溶质沉积。
(5)纯物质过冷液体的化学势大于其固体的化学势。因为过冷液体变成固体的相变过程是自发过程。
(6)自由水分子的化学势大于与多孔硅表面吸附的水分子的化学势,因为在吸附进行的过程中,自由水分子吸附到多孔硅表面时自发过程。
问题十:理想气体与理想液态混合物的微观粒子间的相互作用有何区别?
回答:
想气体的分子间不存在相互作用,而理想液态混合物的粒子间存在相互作用,不论是同种粒子还是异种粒子之间的作用力都相同。
问题十一:溶液中的组分与液态混合物中的组分有何区别?热力学处理时有何不同?
回答:
溶液可以是气体、固体、液体(量少)溶于液体形成的,气体、固体、液体(量少)称为溶质,液体称为溶剂。而液态混合物中必须是两种液体混合而得的,用热力学处理时,混合物中任一组分的组成都用摩尔分数xB表示,其化学势公式都按服从或近似服从拉乌尔定律来得出的;溶液中的组成溶剂用摩尔分数xA表示。其化学势按拉乌尔定律来得出,溶质组成可以是摩尔分数xB、体积摩尔浓度cB、质量摩尔浓度mB,其化学势按亨利定律处理得出。
问题十二:怎样从微观上理解理想液态混合物中的每一种组分在全部组成范围内都服从拉乌尔定律?
回答:
因为理想液态混合物中每一种组分的分子与其周围异种组分的分子之间的相互作用,与它处于纯态时的同种分子之间的相互作用情况是一样的,即同种分子与异种分子大小相近,作用力大小相同,因此理想混合物在全组成范围内才服从拉乌尔定律。
问题十三:溶液的化学势等于溶液中各组分的化学势之和,这种说法对不对?
回答:
不对。化学势是某组分的偏摩尔吉布斯自由能,是强度性质的量,没有加和性,另外溶液中存在溶剂的化学势、溶质的化学势,而没有整个溶液化学势的概念。

