第四章 相平衡
 知识点二:单组分系统
知识点二:单组分系统
一、克拉贝龙方程
从ΔG的计算中我们了解到,对于正常相变,两相吉布斯自由能变化ΔG=0,由于ΔG是相平衡温度和压力的函数,即ΔG(T, p)=0。所以单组分系统处于两相平衡时,温度和压力应满足一定的函数关系,而这种函数关系正是克拉贝龙方程所反映的内容。设单组分B在T、p时处于![]() 和
和![]() 两相平衡,即
两相平衡,即
根据等温等压相平衡条件ΔG=0可得
若温度改变dT,相应地压力改变d p时,两相仍维持平衡,则
上两式相减,得
由热力学的基本关系式(2.40)得
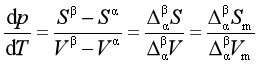
在正常相变时,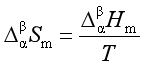 则
则
 (1)
(1)
此式称为克拉贝龙(Clapeyron)方程式。它表明单组分系统两相平衡时,压力随温度的变化率与相变焓成正比,与温度和相变体积的乘积成反比。该式适用于纯物质的任何两相平衡(如液—气、液—固、固—固平衡等)系统。例如对液—气两相平衡为
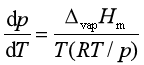
整理可得
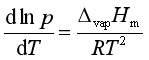 (2)
(2)
此式称为克劳修斯—克拉贝龙方程式。需指出的是,式(2)对固—气两相平衡也适用,只是将其中的蒸发焓![]() 换成升华焓
换成升华焓![]() 即可。若假设
即可。若假设![]() 与温度无关,积分式(2),得
与温度无关,积分式(2),得
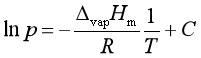 (3)
(3)
此式为克劳修斯—克拉贝龙方程的不定积分式。从此式可看出,若以ln p对![]() 作图,可得一直线,由直线的斜率可以求得
作图,可得一直线,由直线的斜率可以求得![]() 。若对式(2)作定积分,并设
。若对式(2)作定积分,并设![]() 为常数,可得
为常数,可得
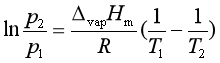 (4)
(4)
由式(4)可知,若已知温度T1时的蒸气压p1,可求出另一温度T2时的蒸气压p2,但需要知道ΔvapHm。而ΔvapHm可利用下面的楚顿规则近似计算:
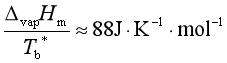
式中Tb*为液体的正常沸点,即在标准压力下液体的沸点。该规则适用于在液态和气态中没有缔合现象的液体(称为正常液体),对极性较高的液体或正常沸点低于150K的液体则误差很大。
二、外压对蒸气压的影响
在一定温度下液体与其自身的蒸气达平衡时的压力称为在该温度下液体的饱和蒸气压(用pv*表示),简称蒸气压。此时在液体的上方除了该液体的蒸气之外没有其他气体,液体所受的压力也就是液体的蒸气压pv*。但如果将液体置于惰性气体之中,例如在空气中(设空气不溶于该液体),液体所受压力就是大气的压力p,则此时液体的蒸气压pv将大于pv*。
设在一定温度T和一定外压p时,液体B与其蒸气呈平衡,此时液体的压力即为外压p,而蒸气的压力为液体的蒸气压pv,即
液体B(T,p)![]() 蒸气B(T,pv)
蒸气B(T,pv)
![]()
若保持温度不变,外压改变dp,则蒸气B的蒸气压需改变dpv时,才能维持平衡,即
上两式相减,得
即
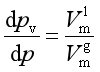
或
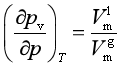 (5)
(5)
此式即为外压对蒸气压影响的关系式。由此式可看出,因![]() >0,故蒸气压随外压的增大而增大,但通常情况下(远离临界状态时),由于
>0,故蒸气压随外压的增大而增大,但通常情况下(远离临界状态时),由于![]() 很小,所以蒸气压随外压的变化率
很小,所以蒸气压随外压的变化率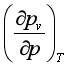 可忽略不记。若蒸气可视为理想气体,即
可忽略不记。若蒸气可视为理想气体,即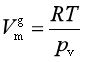 ,代入式(5)中整理可得
,代入式(5)中整理可得
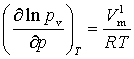 (6)
(6)
对此式积分,并设Vml为常数,则得
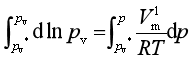
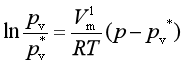 (7)
(7)
式中pv*是没有惰性气体(此时液体的压力也是pv*)时液体的蒸气压;而pv是有惰性气体(此时液体的压力即为外压p)存在时的蒸气压。
例3 已知丙烯的正常沸点是225.6K,在夏季阳光(333K)下,估算耐多大压力的储罐可满足储存液体丙烯的要求?
解:首先根据楚顿(Trouton)规则估算丙烯的摩尔蒸发焓:
再根据克劳修斯—克拉贝龙方程计算丙烯在T=333K时的蒸气压p。由题意可知,T1=225.6K,p1=![]() =100kPa。则
=100kPa。则
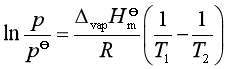
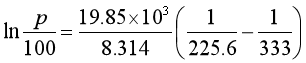
p=3034kPa
即储罐至少耐压为3034kPa才能满足储存液体丙烯的要求。
三、单组分系统相图
1.相图绘制
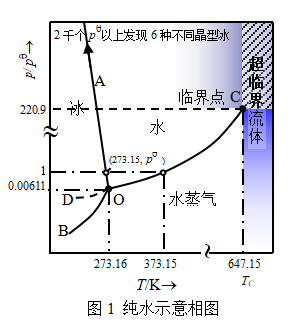
单组分系统中,最简单的是纯物质构成的系统,K=1,自由度数:![]() 且
且 =1~3,所以0
=1~3,所以0![]() f
f ![]() 2,相图上表现为双变量(面)、单变量(线)、和无变量(点)三种可能的系统,通常研究p-V-T图的恒容投影即p-T图。
2,相图上表现为双变量(面)、单变量(线)、和无变量(点)三种可能的系统,通常研究p-V-T图的恒容投影即p-T图。
首先研究纯水的相图。将水放在抽去空气的封闭容器内,此时,水仅处于其自身的蒸气压之下。测定三物种和两相物理平衡的温度和压力实验数据(表1),绘出水在封闭和恒容的空间中两相共存曲线,示于图1,此即纯水的相图。
2. 相图分析
(1)面:三条两相平衡线将相图划分为三个平面区,分别为水蒸气、液态水和固态冰。每一个区域内,  =1,f=2。系统温度和压力都可以独立变动,而不会引起相的改变。但是这种变动不能超越界限。只有同时指定温度和压力这两个变量,致自由度数为0,系统的状态才能确定。
=1,f=2。系统温度和压力都可以独立变动,而不会引起相的改变。但是这种变动不能超越界限。只有同时指定温度和压力这两个变量,致自由度数为0,系统的状态才能确定。
(2)线:三条曲线是两个“相”区的交界线,线上 =2,f=1。温度和压力中只能有一个是独立变量。
=2,f=1。温度和压力中只能有一个是独立变量。
BO线:升华曲线,压力随温度是增函数,理论上向下延伸至绝对零度附近。
OC线:汽化曲线,压力随温度是增函数,临界点(临界温度、压力和体积)终止。
OA线:熔化曲线,压力随温度是减函数,近似直线,![]() <0,因此OA向左倾斜。这与大多数单组分系统固-液平衡时p~T线是增函数,斜率为正,熔化曲线向右倾斜的情况不同。要使冰的熔点降低,必须增加压力。仅因冰熔化成水时,体积减小,按照勒夏特列平衡移动原理,增加压力,有利于体积减小的过程,即有利于冰的熔化,因而冰的熔点降低。当OA线延伸,达到2.027x108Pa以上的高压时,目前已发现有6种不同冰晶形态与液态水共存。
<0,因此OA向左倾斜。这与大多数单组分系统固-液平衡时p~T线是增函数,斜率为正,熔化曲线向右倾斜的情况不同。要使冰的熔点降低,必须增加压力。仅因冰熔化成水时,体积减小,按照勒夏特列平衡移动原理,增加压力,有利于体积减小的过程,即有利于冰的熔化,因而冰的熔点降低。当OA线延伸,达到2.027x108Pa以上的高压时,目前已发现有6种不同冰晶形态与液态水共存。
DO线:过冷水汽化曲线,因过冷水蒸气压大,化学势过高,所以过冷水不稳定。这种能存在一定时间但又不稳定的状态称为亚稳态(见表1)。
(3)点: 水的相图上有两个重要的点,所在的点处f =0,属无变量系统。
O点:三条曲线的交点,是纯水的三相点,冰-液-汽三相共存, =3。1934年,我国著名物理化学家黄子卿先生经反复测试确定:水的三相点温度为t=(+0.00981±0.00005)°C,作为热力学温标的单一“固定点”,热力学温度每K是水的三相点热力学温度的1/273.16。
=3。1934年,我国著名物理化学家黄子卿先生经反复测试确定:水的三相点温度为t=(+0.00981±0.00005)°C,作为热力学温标的单一“固定点”,热力学温度每K是水的三相点热力学温度的1/273.16。
这其中,水的三相点比普通水的冰点高约0.01K,原因是:纯水三相点的平衡蒸气压是610.62Pa,而普通水则处于常压(以1工程压101.325kPa计)下,由克拉贝龙方程可求得因压力的差别而引起的温度偏差是0.00747K;普通水被含CO2、N2、O2的空气所饱和,实际上是一种稀溶液,溶液冰点因溶质的存在而下降0.00242K。二项偏差使水的冰点下降了0.00989K。另外,三相点是在密闭固定平衡条件下测定的,因而不随地理位置而变化,这也是与普通水的冰点具有差别的原因之一。
C点:临界点(TC=647K,pC=2.2x107Pa)。临界点以上(图1中细斜线部分),便是超临界流体,相界面消失,气相与液相融合成一个均一的流体相, =1。超临界水氧化技术应用于冶污环保领域的成就越来越引起人们的关注,它是以水为介质,利用超临界流体作为溶媒时不存在气液界面的传质阻力来提高反应速率并实现完全氧化的,在处理废水和处理难降解或难生化废物方面具有独特的优势。此外,超临界水在催化、有机合成、萃取等方面也同样受到人们的关注。至今仅发现气液平衡线上有临界点,固液平衡线上不会有临界点目前是以对称晶体结构与等方流体间不可能存在状态连续为认识依据的。
=1。超临界水氧化技术应用于冶污环保领域的成就越来越引起人们的关注,它是以水为介质,利用超临界流体作为溶媒时不存在气液界面的传质阻力来提高反应速率并实现完全氧化的,在处理废水和处理难降解或难生化废物方面具有独特的优势。此外,超临界水在催化、有机合成、萃取等方面也同样受到人们的关注。至今仅发现气液平衡线上有临界点,固液平衡线上不会有临界点目前是以对称晶体结构与等方流体间不可能存在状态连续为认识依据的。
四、CO2相图
图2是CO2的p -T平面图,该图指出
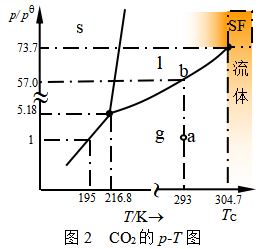
(1) 将二氧化碳在293K时液化所需最小压力为5.70MPa。
(2) 当外压低于5.18个标准压力(pө=100kPa)时,二氧化碳不能以液态存在,因而常温常压下CO2由高压钢瓶向通常1个大气压的空气喷出时,大部分成为气体,一部分成白色固体(干冰)。故钢瓶存放温度也不能高于临界点(C点)温度,以免成流体漏泄。
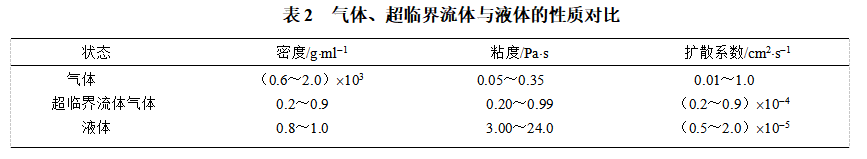
(3)超临界流体兼有气体和液体双重特性,扩散系
(4)数和粘度接近气体而密度和对溶质溶解性能接近液体。超临界流体与气体、液体的性质对比见表2。流体CO2常用作超临界萃取(Supercritical Fluid Extraction,简写作SFE)的萃取剂。它性质稳定,无毒,使用安全,价格低廉,临界点低,易于操作 。
在形成超临界流体条件下,改变压力或温度,都可引起流体粘度、密度和扩散系数的变化,即可改变超临界流体的溶解特性。二氧化碳的临界温度为304.7K,临界压力为7.37MPa。当温度为313K时,二氧化碳的密度和介电常数随压力的增加而加大,溶解性能也随之改变。也就是说,在—定的超临界温度条件下,改变压力即可改变超临界流体的极性。因此,先对气体施加足夠的温度和压力使之成为超临界流体,然后用它作为超临界溶剂对有机物或药材进行提取,提取后得到的溶有有用化学成分的流体通过改变压力或同时改变温度,使之进入临界点以下相区,此时超临界流体又转为气体,对物质的溶解能力大大下降,被提取成分即可析出,并与气体分离。另外,利用程序升压可将不同极性的成分进行分步提取和分离,提取液在临界点以上时,各组分在流体中可以任何比例互相混合,但经过减压或同时降温使其进入临界点以下相区时,各组分就会分别析出。
(5) 在研究全球变暖的温室效应专题上,如何减少甲烷、CO2气体等的漏泄、排放并改善环境,也备受世人关注。
典型单组分相图还有硫的相图,因为固态硫出现正交晶硫(a)和单斜晶硫(b)两种同素异构体,所以其相图特征是出现四个三相点。
例4 根据图4.2 CO2相图回答:
(1)将CO2在273K时液化,需要多大压力?
(2)CO2自钢瓶或灭火器中喷出时,大部分成为气体,小部分成为固体(干冰),温度下降到多少度,才能完全形成固体CO2?
(3)在空气中(101325Pa下)温度为多少度可使固体CO2不经液化而直接升华。临界点(Tc)以上是什么物态?SF是什么意义。不经过相变点气体能变成液体吗?
(4)指出CO2相图与水的相图的最大差别在哪里?
解:(1)借助于克拉贝龙-克劳修斯方程可以算得273.15K时CO2液化压力为3458kPa;(2)216.6K以下;(3)195.0K,临界点以上是流体。图中SF是超临界的缩写。CO2是常用的超临界(Tc)萃取剂。可以经升温-升压-降温-降压,在临界点以上绕行。则气体可以不经过相变点而变成液体;(4)CO2相图的固-液平衡线斜率是正值。
