第四章 相平衡
 知识点四: 二组分液-液平衡系统
知识点四: 二组分液-液平衡系统
一、液-液平衡相图
1.部分互溶双液系
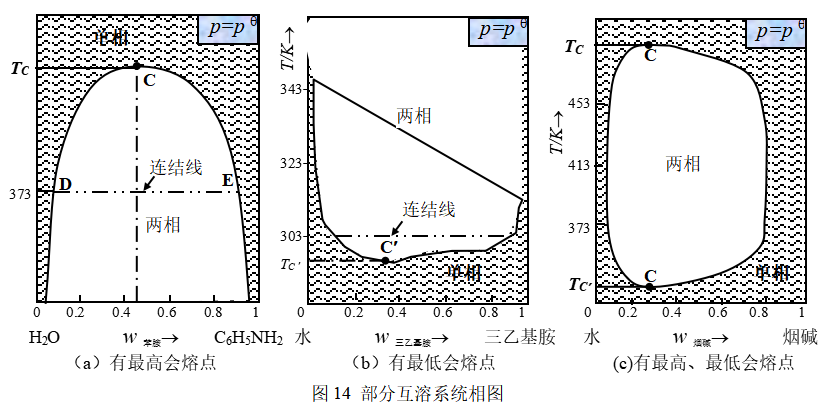
性质差别(诸如分子的极性)较大的两种液体,混合后在一定的温度和浓度范围内会形成两个液相,这便是部分互溶系统(图14)。将具有两个液层的系统升高或降低至某个温度,两个液层的界面消失而成为一个液相,这个时候的温度便称为最高会溶温度或最低会溶温度。水-苯胺、水-正丁醇或水-酚系统是属于具有最高会溶温度的类型[图14(a)],水-三乙基胺系统是属于具有最低会溶温度的类型[图14(b)],水-烟碱、间甲苯胺-甘油系统是属于兼有最高、最低会溶温度的类型[图14(c)],乙醚-水则属于在其液相范围内根本就不具有会溶温度的类型(请读者绘出该类型的示意相图)。
水与苯胺形成的二组分系统在低温下部分互溶,系统分层,两相平衡共存,一相是苯胺的水溶液,另一相是水的苯胺溶液。一条结线连接一对互相饱和的溶液,称为共轭溶液,平衡两相的相对质量比符合杠杆规则。温度升高,苯胺在水中的溶解度沿DC上升,水在苯胺中的溶解度沿EC上升。两液相组成逐渐接近,温度升至TC,系统点到达会溶点C,成为完全互溶的单相。高于C点,都是两组分完全互溶成为单相。根据相律,系统点落在两相平衡区内的自由度数为1,落在阴影单相区内的自由度是2,在会熔点,自由度等于0。
2. 完全不互溶双液系
两种液体在性质上差别更大时,彼此间的溶解度极其微小,便可看作为完全不互溶系统。水与烷烃系列(烷烃、环烷烃、芳香烃等)、水与卤代烃等构成的系统都属于此例。
不互溶的液体共存时,各组分几乎互不影响,它们的蒸气压与单独存在时一样,只是温度的函数。与其它组分的存在及它们数量的多少均不相关。所以不互溶两组分的蒸气压应等于它们单独存在时的蒸气压之和:
![]() (11)
(11)
所以,完全不互溶系统的总压高于任一纯组分的蒸气压,而沸点则低于任一纯组分的沸点。
3. 水蒸气蒸馏
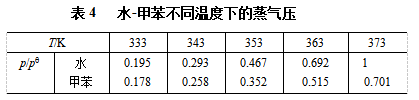
表4.4列出了水-甲苯在不同温度下的蒸气压数据,据式(11)作出p-T图如图15。这个系统在外压为标准压力pө时的沸点在图中可以查得是357K。显然,两液体共沸时,以某一比例一起被蒸出来,由于不互溶,冷凝液容易分开。根据这个原理,常把不溶于水的有机化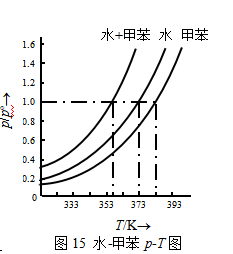 合物和水一起蒸馏,而使系统的沸点大大降低,从而避免有机物的分解。这种方法称为水蒸气蒸馏。适用于高沸点易分解,且不溶于水的有机物的小批量产品的提纯,比同样可以采用的减压蒸馏的设备和方法简单,而且费用低。水蒸气蒸馏也适用于混合物沸点较各纯组分沸点更低的部分互溶系统的分离,例如水-苯胺混合系统。
合物和水一起蒸馏,而使系统的沸点大大降低,从而避免有机物的分解。这种方法称为水蒸气蒸馏。适用于高沸点易分解,且不溶于水的有机物的小批量产品的提纯,比同样可以采用的减压蒸馏的设备和方法简单,而且费用低。水蒸气蒸馏也适用于混合物沸点较各纯组分沸点更低的部分互溶系统的分离,例如水-苯胺混合系统。
水蒸气蒸馏时水的用量可根据分压定律计算。在共沸点时
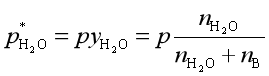
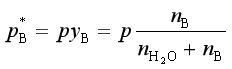
p是总压,上两式相除得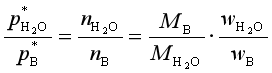
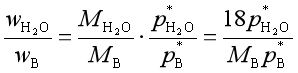 (12)
(12)
![]() 称为水蒸气消耗因子。式(12)表明,若有机物B的饱和蒸气压越大,摩尔质量越大,则水蒸气消耗因子越小,水蒸气蒸馏的效率就越高。
称为水蒸气消耗因子。式(12)表明,若有机物B的饱和蒸气压越大,摩尔质量越大,则水蒸气消耗因子越小,水蒸气蒸馏的效率就越高。
例4 水与氯苯不互溶系统的共沸点为363.4K,该温度下水与氯苯的蒸气压分别为72.4kPa及28.9kPa,如使提纯100kg氯苯,耗用水蒸气多少kg?
解
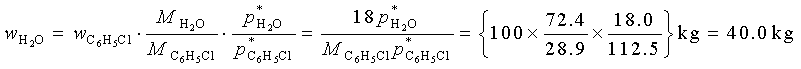
二、气-液、液-液平衡的组合
1.液相完全互溶向部分互溶的过渡
水-正丁醇二元系由于二种分子间的相互吸引力很小,所以具有很大的正偏差。在标准压力下的沸点-组成(气-液)图如图16。常温下的溶液成互相饱和的两液层。当升温出现气相时,形成具有最低恒沸点类型的气-液平衡。
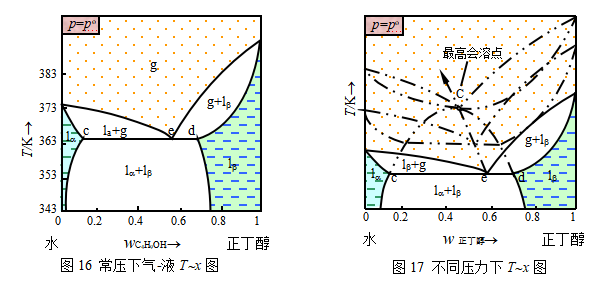
图16中,温度在365.91K(共沸点)时,两液体已经不能完全互溶而形成两个共轭溶液层(α液相和β液相),并与气相(e)共存,所以ced称为三相线,二组分三相平衡时的自由度是1,其意是指压力为不确定数。一旦p或T确定,三相线的自由度数为0(相律公式f*=K- +1)。这种T-x图的形成与压力有关,当压力改变时,对于液-液平衡的影响很小,液-液平衡弧圈形曲线的位置和形状变化不明显。但对气-液平衡的影响就很大了,当压力降低到一定程度时(图17),气-液平衡曲线(二片眼形区)将与液-液平衡曲线(弧圈线)相交而重叠,使气-液、液-液两张相图组合而形成高温气-液及低温液-液平衡的相图。系统的沸点温度到了会溶温度以下,致溶液分层。出现三相线,成为部分互溶双液系的系列相图。
+1)。这种T-x图的形成与压力有关,当压力改变时,对于液-液平衡的影响很小,液-液平衡弧圈形曲线的位置和形状变化不明显。但对气-液平衡的影响就很大了,当压力降低到一定程度时(图17),气-液平衡曲线(二片眼形区)将与液-液平衡曲线(弧圈线)相交而重叠,使气-液、液-液两张相图组合而形成高温气-液及低温液-液平衡的相图。系统的沸点温度到了会溶温度以下,致溶液分层。出现三相线,成为部分互溶双液系的系列相图。
此类系统的精馏别具特色。一般需用双塔,再加一个分相器。设备流程如图18。将正丁醇水料液引入精馏塔I,分馏出水自塔底排放,塔顶则馏出共沸物,经冷凝成液体后进入分相器,分为富醇层(上层a相)和富水层(下层b相),上层转入精馏塔II,下层自塔上部返回精馏塔I,在塔II底部精馏得到纯品正丁醇。
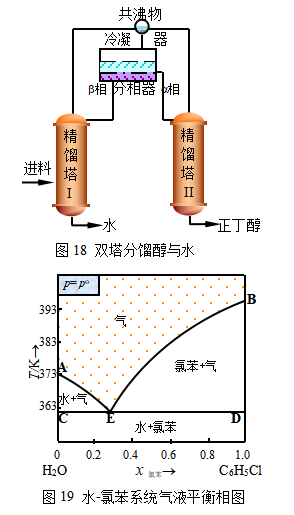 塔顶则分馏出共沸物,反复分馏、分相便可实现正丁醇与水的完全分离。还可根据需要选择加压蒸馏或减压蒸馏。工业上常利用共沸物分层的特点进行物质的分离,例如,自糠醛水溶液中提取糠醛,含酚水溶液的浓缩,含水丙烯腈的脱水等等。
塔顶则分馏出共沸物,反复分馏、分相便可实现正丁醇与水的完全分离。还可根据需要选择加压蒸馏或减压蒸馏。工业上常利用共沸物分层的特点进行物质的分离,例如,自糠醛水溶液中提取糠醛,含酚水溶液的浓缩,含水丙烯腈的脱水等等。
2.液相部分互溶向完全不互溶的过渡
完全不互溶系统如水-氯苯的气-液平衡相图如图19所示。可以看出,这类系统与部分互溶系统的区别是,在共沸点E以下,随着不互溶程度的增大,两液层由原来的共轭溶液趋于两层不互溶的纯组分。在典型的部分互溶相图16或17中,标注着lα+lβ的两块互溶区的面积逐渐缩小,而趋于零。于是形成图19。AE、BE是气相线,也是水及氯苯的饱和蒸气压(或者冷凝)曲线。与它们平液衡共存时的相线则分别是AC和BD。CED是三相线,线上f*=0。E是作为三相线上的一个相点,与单组分相图的三相点是有差别的,生产中常依据这类相图,由有机混合气中含水率的多少来判断首先冷凝出来的应是什么纯组分。
