一、填空题
1、相平衡系统的组分数![]() ,其中
,其中![]() 是 数,
是 数,![]() 是独立的
是独立的
数。
2、热力学的“相”是系统中 性质和 性质完全均匀的部分。
3、自由度是描述系统相平衡状态的独立的 变量。根据相律,相平衡系统自由度数![]() 。
。
4、对于 系统而言,当处于两相平衡时,压力随温度的变化率![]() 遵守克拉贝龙方程,即
遵守克拉贝龙方程,即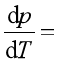 。
。
5、定温下,纯液体B的蒸气压![]() 随着外压
随着外压![]() 的增加而 ,其定量关系可表示为:
的增加而 ,其定量关系可表示为: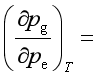 。
。
6、定压下,水和乙醇形成最低恒沸混合物,恒沸组成为95.57%(质量分数),用市售的60°烈性白酒,经过精馏后,气相得到 ,液相得到 。
7、在温度T时,纯液体的饱和蒸气压为p。则以lnp对 作图可得一条直线,该直线的斜率为 。
8、![]() 与
与![]() 能形成:
能形成: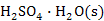
![]() 、
、![]() 、
、![]()
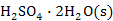 和
和![]() 四种稳定的水合盐。该系统的组分数
四种稳定的水合盐。该系统的组分数![]() 。在
。在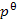 下,该系统的相图中有
下,该系统的相图中有
个低共熔点。
9、A、B二组分构成理想液态混合物,若![]() >
>![]() ,则达到气、液两相平衡时,组分B在气、液两相浓度:
,则达到气、液两相平衡时,组分B在气、液两相浓度:![]()
![]() ;化学势:
;化学势:![]()
![]() 。
。
10、将混合液精馏(分馏)的原理即是,把液相部分气化,把气相部分冷凝,则能够在液相富集 组分,在气相富集 组分。
二、判断题(对者写“√”,错者写“×”)
1、在一抽真空的容器中放入纯氯化铵固体,反应:![]() 达到平衡。该反应系统的组分数
达到平衡。该反应系统的组分数![]() 1,自由度数
1,自由度数![]() 1。
1。
2、“杠杆规则”只能用于两相平衡共存系统,而不能用于非平衡两相系统。
3、恒沸混合物的组成随着外压的改变而改变,并非恒定不变。
4、液态水的密度大于冰的密度,则冰与水处于两相平衡时,压力随温度的变化率![]() <0。
<0。
5、定温下,纯物质的蒸气压随着外压的增大而增加。
6、在一个给定的系统中,物种数可以因分析问题角度的不同而不同,但独立组分数是个确定的数。
7、杠杆规则只适用于T一x图的两相平衡区。
8、对于二组分互溶双液系统,通过精馏方法总可以得到两个纯组分。
9、若A、B两液体完全不互溶,那么当有B存在时,A的蒸气压与系统中A的摩尔分数成正比。
10、在简单低共熔物的相图中,三相线上的任何一个系统点的液相组成都相同。
三、单项选择题(下列各题的4个选项中,只有1个正确答案)
1、NH4HS(s)和任意量的NH3(g)及H2S(g)达平衡时,有
A、C= 2,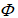 = 2,f= 2 B、C= 1,
= 2,f= 2 B、C= 1,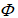 = 2,f= 1
= 2,f= 1
C、C= 2,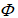 = 3,f= 2 D、C= 3,
= 3,f= 2 D、C= 3,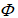 = 2,f= 3
= 2,f= 3
2、CuSO4与H2O可生成CuSO4·H2O(s)、CuSO4·3H2O(s)、CuSO4×5H2O(s)三种水合物,则在一定温度下能与硫酸水溶液及冰平衡共存的含水盐可有
A、3种 B、2种 C、1种 D、0种
3、将固体NH4HCO3(s)放入真空容器中,恒温至400 K时,按下式分解并达到平衡:
则系统的组分数C和自由度数f 为
A、C= 2, f= 1 B、C= 2, f= 2
C、C= 1, f= 0 D、C= 3, f= 2
4、298 K 时,蔗糖水溶液与纯水达渗透平衡时,系统的相数、自由度数为:
A、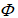 = 2,f*= 1 B、
= 2,f*= 1 B、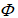 = 2,f*= 2
= 2,f*= 2
C、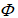 = 1,f*= 2 D、
= 1,f*= 2 D、 = 1,f*= 3
= 1,f*= 3
5、Na2CO3可形成Na2CO3·H2O,Na2CO3·7H2O 及Na2CO3·10H2O三种水合盐,常压下将 Na2CO3(s) 投入其水溶液中并降温,待达三相平衡时,有二相分别是Na2CO3(s) 和Na2CO3水溶液,则另一相是:
A、Na2CO3·H2O(s) B、Na2CO3·7H2O(s)
C、Na2CO3·10H2O(s) D、H2O(s)
6、关于水的相图,下列说法正确的是
A、在三相点处,![]() ;在临界点处,
;在临界点处,![]() 。
。
B、当冰与水处于两相平衡时,压力随温度的变化率![]() < 0
< 0
C、在相图中的曲线上,![]() ,
,![]()
D、三相点的温度低于冰点的温度
7、在101325Pa压力下,冰与被空气饱和了的水成平衡的温度称为
A、凝固点 B、冰点 C、三相点
D、露点
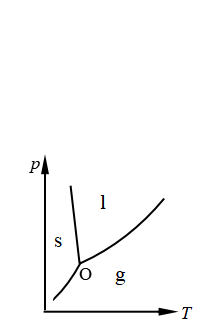
8、如右图所示,纯水处于三相点(O)平衡时,若系统发生绝热膨胀,相态的变化是
A、固相消失,气相、液相共存
B、液相消失,气相、固相共存
C、液、固相消失,全气态
D、气、液相消失,全固态
9、水和溴苯的混合液可视为完全不互溶系统。水的正常沸点为100 ℃,溴苯的正常沸点为156 ℃,在pӨ下,将溴苯进行水蒸气蒸馏时,其沸点![]() 满足
满足
A、![]() <100 ℃, B、100 ℃<
<100 ℃, B、100 ℃<![]() <156 ℃
<156 ℃
C、![]() <156 ℃ D、
<156 ℃ D、![]() 取决于溴苯量的多少
取决于溴苯量的多少
10、在323 K时,苯–甲苯混合物气液平衡相图中,纯苯的蒸气压为0.991 pӨ,纯甲苯的蒸气压为0.382pӨ,气相中苯的摩尔分数为y苯=0.50,则液相组成x苯。
A、0.85 B、0.65 C、0. 50 D、0.20

