一、基本内容
本章运用热力学方法推导相平衡系统共同遵守的规律—相律;介绍单组分或多组分系统内达平衡时的状态图—相图的绘制、相图的分析和相图的应用。通过本章的学习,可以应用相律判断各类相平衡系统中的相数、组分数和自由度数;了解各类相图的绘制方法,正确分析相图中各点、线、面的意义,解释外界条件变化时系统经历的相变,并能根据所给条件粗略画出相图;能应用杠杆规则计算相平衡系统中各相的相对数量,明确蒸馏、精馏、结晶、萃取等工业过程分离、提纯物质的基本原理和最佳途径。
(一)相律
系统达热力学平衡时,若有C种组分,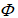 个相,通常仅将温度与压力2个强度性质考虑进去,组成一个全部是独立变量的以自由度数f表达的函数关系式: f =C-
个相,通常仅将温度与压力2个强度性质考虑进去,组成一个全部是独立变量的以自由度数f表达的函数关系式: f =C-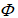 +2。此即为吉布斯相律公式。如有磁场、重力场以及有渗透压等其它因素影响,则应将常数2改为n。
+2。此即为吉布斯相律公式。如有磁场、重力场以及有渗透压等其它因素影响,则应将常数2改为n。
(二)克拉贝龙(Clapeyron)方程
单组分两相平衡系统,压力随温度的变化率为
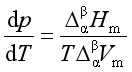
对于气—液(或气—固)平衡
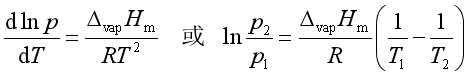
上式即为克劳修斯—克拉贝龙方程。
对于正常液体,![]() 可利用特鲁顿(Trouton)规则近似计算
可利用特鲁顿(Trouton)规则近似计算
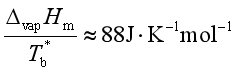
其中![]() 为液体的正常沸点。
为液体的正常沸点。
外压对蒸气压的影响
在一定温度T和一定外压![]() 时,液体B与其蒸气呈平衡,液体的压力即为
时,液体B与其蒸气呈平衡,液体的压力即为![]() ,设液体的蒸气压为
,设液体的蒸气压为![]() ,则
,则
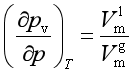
若蒸气视为理想气体,则
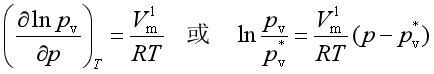
(三)相图
相图是一些描述相平衡规律的图形。将吉布斯相律与相图相结合,可以了解多相平衡系统在不同T、p、x条件下的相态变化。系统的组分数不同,相图的绘制方法及相图的形貌也不尽相同。

1.单组分系统,重点研究p-T图
参考图4-1,单组分系统C=1,f=C- +2单相(面积区)时,
+2单相(面积区)时, 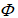 =1,f =2,温度和压力均可变,称为双变量系统;在汽化、凝固和升华时两相平衡的三条线上,
=1,f =2,温度和压力均可变,称为双变量系统;在汽化、凝固和升华时两相平衡的三条线上,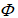 =2,f =1,即温度与压力只有1个可变,称为单变量系统;而相平衡的三相点(O点),
=2,f =1,即温度与压力只有1个可变,称为单变量系统;而相平衡的三相点(O点),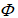 =3,f =0,称为无变量系统,意味着状态确定,相关因素即温度、压力和组成都是定值,没有变量。所以单组分系统最多有2个自由度,最多三相平衡共存。
=3,f =0,称为无变量系统,意味着状态确定,相关因素即温度、压力和组成都是定值,没有变量。所以单组分系统最多有2个自由度,最多三相平衡共存。
单组分二相平衡时,符合克拉贝龙方程式;其中有气相存在时还符合克拉贝龙-克劳修斯方程式。
纯水三相点(图中O)被定义为热力学温标的单一固定点;临界点(图中C)时各相密度相同,经验告诉,非极性分子的许多物质,临界点温度约为液体正常沸点的3/2。超临界概念在萃取有用物质和环保分离污染物质方面具有重要意义。
2.二组分系统相图,重点研究T-x图
二组分系统C=2,若给予恒温条件,可作p-x图;给予恒压条件,可作T-x图,T或p一定时也可称条件自由度(f*),因为自由度f*=2+1-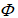 = 3-
= 3-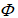 ,意味着最多三相共存。
,意味着最多三相共存。
(1)气-液平衡相图,主要类型见图4-2。
相图类型及其特征:理想液态混合物(a)与实际液态混合物(b),在p-x图上差别明显;完全互溶(c)、(d),部分互溶(e),(具最低恒沸点的完全互溶系统与部分互溶系统的组合,液相l1、l2是共轭溶液)。
实验用沸点仪作气-液平衡系统的T-x相图;
相律应用:定压下,单相区f*=2;二相(梭形、三角)区f*=1;最高、最低恒沸点时f*=0;
相图形成及其应用:①根据相似相溶原理寻找理想液态混合物,p-x相图上,理想液态混合物的蒸气总压![]() 符合线性的特征。②实际液态混合物对拉乌尔定律的正、负偏差过大则导致T-x图上出现最高、最低恒沸点。③应用完全互溶双液系相图进行蒸馏与分馏,也可结合选择加压或减压蒸馏。④部分互溶系统出现共轭溶液,高、低会溶点过渡至完全互溶,可利用气-液、液-液平衡的组合设计双塔分馏。⑤完全不互溶双液系统,通常研究它的的p-T相图应用于水蒸气蒸馏。
符合线性的特征。②实际液态混合物对拉乌尔定律的正、负偏差过大则导致T-x图上出现最高、最低恒沸点。③应用完全互溶双液系相图进行蒸馏与分馏,也可结合选择加压或减压蒸馏。④部分互溶系统出现共轭溶液,高、低会溶点过渡至完全互溶,可利用气-液、液-液平衡的组合设计双塔分馏。⑤完全不互溶双液系统,通常研究它的的p-T相图应用于水蒸气蒸馏。
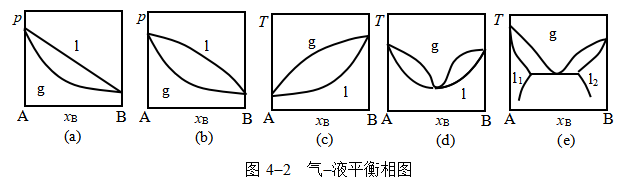
(2)固-液平衡相图,主要类型见图4-3。
绘制固-液平衡相图常用热分析法或溶解度法,前者用于熔点较高的合金系统,后者用于常温下呈液态的系统,主要是水盐系统。
利用差热分析可求物理的、化学的反应温度,相变、 晶变、脱水、分解等过程的热效应值。
相图的类型及其特征
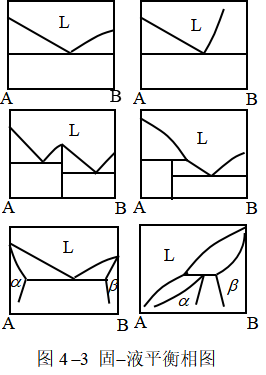
①固态完全不互溶的固液平衡T-x相图
a.有简单低共熔混合物。
b.形成稳定化合物(又称具有相合熔点的化合物)。
c.形成不稳定化合物(又称具有不相合熔点的化合物)。
②固液部分互溶的固液平衡相图
a.存在固溶体单相区。
b.存在转熔温度。
二组分系统T-x相图还有以下共同特征:
a.图中的水平线都是三相线。
b.图中垂线都表示纯物质(单质或化合物),垂线顶端与曲线相交者是稳定化合物;与水平线相交成“T”字形者则是不稳定化合物。
c.固溶体的特征为:围成固溶体的不规则图形内无任何水平线。
d.杠杆规则只适用于二相区。
利用二组分固-液平衡相图应明确以下问题:金属的分离和提纯;结合“退火”、“淬火”等工艺控制合金的内部结构;盐类的分离和粗盐精制以及在现代材料制造方面的应用。
此外,一般地了解风化与潮解(二组分固-气类p-T相图,常用于解释地质现象):凡在某温度下,大气中的水蒸气压小于含水盐中的水蒸气压时含水盐会失去水分而崩碎,称此现象为风化。反之,若大气中的水蒸气压大于含水盐中的水蒸气压时,盐就被大气中的水分溶解而成溶液,称此现象为潮解。潮解性化合物可用于除湿干燥。湿度标志大气中的水蒸气压相对于同温度下水的饱和蒸气压的比值。
二、重点与难点
1.相律的表述与数学表达式及其中各参量C、F、f、n等的意义。
2.相图的分类、分析及其在分离提纯等化工工艺中的应用。
(1)明确相图中各区、线、点的意义;据相律及其公式进行有关相数、组分数及自由度数的计算。
(2)理解系统点在相图中移动所经历的相变过程及其应用。
a.纵、横向变化:
①单组分p-T图中升降压、升降温;
②二组分T-x图中升降温、等温浓缩或稀释。
b.斜向变化:
表示三组分三角相图中浓度的变化。须结合正三角形相图要点理解:
①由一顶点至其底边的直线分其余两顶点物质的含量成定比;
②由系统点引平行于三条边的平行线,三线段的长度之和等于一条边长;
③由系统点引三条边的垂线,三垂线的长度之和等于一条高的长度。
(3)利用杠杆规则进行相关计算,并能找出制取最大量纯净物质的最佳工艺路线。
(4) 熟练掌握相平衡重要实验技术及其应用。
3.根据实验结果或者已知条件粗略画相图
1)确定坐标(T~x或T~w),并根据物质含量确定纯物质或化合物在横坐标上的位置;
2)根据三相共存的温度及组成确定水平线位置;
3)根据物质的熔(沸)点,最低(最高)恒沸(恒熔)点,结线结点和会熔点,化合物熔化或分解温度及分解组成等条件,确定相图中的一些特殊点;
4)根据相律,并结合相平衡基本原理,可以回避以下类型错误的相图。
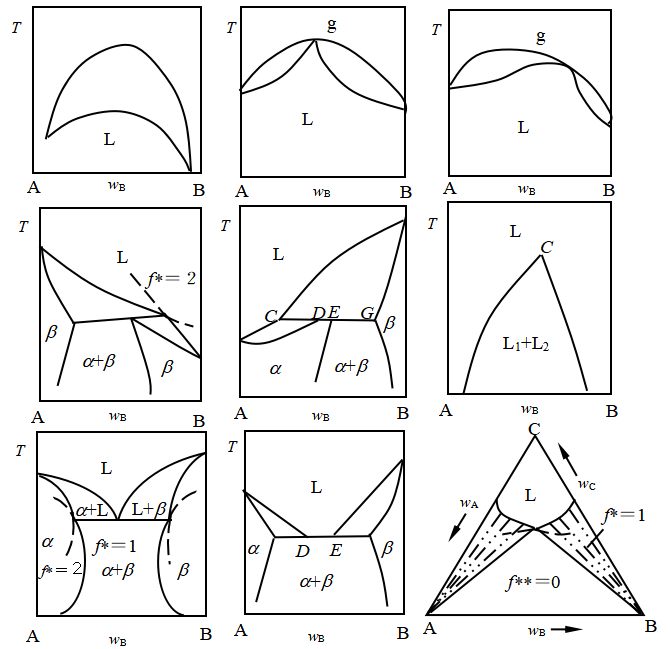
相图中相线的描绘遵循一定的规则,主要有几点:
1) 最高(或最低)点处气、液相具有相同组成;
2)三相线是恒温线,三相线上只能有一个低共熔点;
3)二组分系统的最大平衡相数是3;
4)两液相线交点应是较圆滑的过渡而没有明显的折点,极值导数为零;
5)交点规则:在三线交点处延长的介稳态线指向总是寻找自由度最小的多相平衡区域;
6)过相图中垂线即化合物熔点处的曲线总是圆滑过渡的,极值导数为零,这与两条边线即纯物质饱和溶液曲线的顶点不圆滑形成对比。

