知识点六:同时平衡与反应的耦合
一、同时平衡的概念
以上讨论的平衡系统只限于一个化学反应。而在有些化学反应系统中,同时存在几个反应,且彼此间有共同的反应物质,当系统达到平衡时,各反应之间有一定的相互制约关系,这类平衡称为同时平衡。例如,600 K和![]() 时:
时:
1.CH3Cl(g)+H2O(g) ![]() CH3OH(g)+HCl(g)
CH3OH(g)+HCl(g)
2.2CH3OH(g) ![]() (CH3)2O(g)+H2O(g)
(CH3)2O(g)+H2O(g)
二、同时平衡的判据
当体系中有若干个反应进行时,则系统的自由能变化:
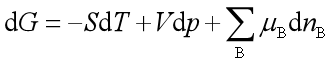
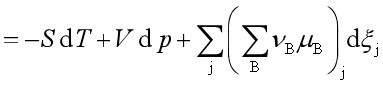
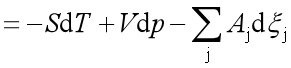
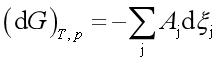
因此,对多个反应同时存在的系统,反应进行的方向和限度的判据是:
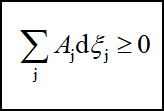
“>”表示自发,“=”表示平衡。当系统达到同时平衡时,任一反应的亲和势都应为零:
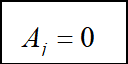
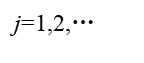
当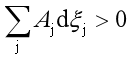 时,整个反应就能自发进行,不论其中是否存在
时,整个反应就能自发进行,不论其中是否存在![]() 反应。例如,在298.2K和
反应。例如,在298.2K和![]() 时:
时:
① TiO2(s) + 2Cl2 (g) ![]() TiCl4(l) + O2 (g) A1= -161.94kJ
TiCl4(l) + O2 (g) A1= -161.94kJ![]() mol-1
mol-1
② C(s) + O2(g) ![]() CO2(g) A2= 394.38 kJ
CO2(g) A2= 394.38 kJ![]() mol-1
mol-1
①+②:C(s) + TiO2(s) + 2Cl2 (g) ![]() TiCl4(l) + CO2(g)
TiCl4(l) + CO2(g)
总结果是![]() ,两反应都自发进行,好像是反应②带动反应①。称之为反应的“耦合”。
,两反应都自发进行,好像是反应②带动反应①。称之为反应的“耦合”。
又如从丙烯生成丙烯腈的反应:
① CH2=CH-CH3 + NH3 ![]() CH2=CH-CN+3H2 A1=-149.10kJ
CH2=CH-CN+3H2 A1=-149.10kJ![]() mol-1
mol-1
② 3H2 + ![]() O2
O2 ![]() 3H2O A2=857.55kJ
3H2O A2=857.55kJ![]() mol-1
mol-1
①和②的耦合反应:
CH2=CH-CH3 + NH3 + ![]() O2
O2 ![]() CH2=CH-CN + 3H2O
CH2=CH-CN + 3H2O
这是目前制取丙烯腈最经济的方法。
接下来让我们进行下一部分的学习
