演示实验——气相化学平衡
一、演示目的
通过N2O4(g)=2NO2(g)的气相化学平衡,亲身体验压力和温度对化学平衡的影响。
二、实验原理
我们以下面气相平衡为例来研究温度和压力对化学平衡的影响
由热力学理论可知:
(1)上述反应为吸热反应,因此当温度升高时反应正向进行;反之,当温度降低时反应逆向进行。
(2)上述反应为体积增加的反应,因此当系统总压力增加时,反应逆向移动;反之当压力减小时,反应正向移动。
三、演示方法
1.温度对平衡的影响
装有N2O4气体的两个密封连通烧瓶(如图1所示),一个放入热水盆中,另一个放入冷水盆中,观察两烧瓶内气体颜色深浅并说明其原因。
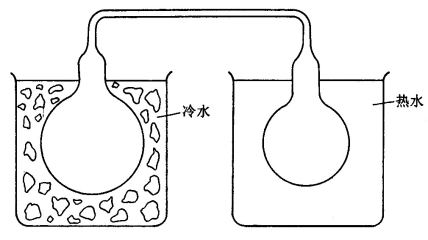
图1 温度影响的演示装置
2.压力对平衡的影响
取装有液态N2O4的小安瓶(注1),用塑料管(或用蜡处理的胶管)接到100 mL注射器上(如图2所示)。然后将塑料管一段安瓶弄破,使N2O4液体气化。
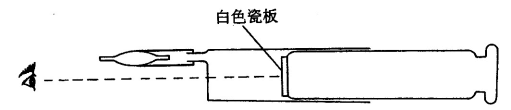
图2 压力影响的演示装置
当用力将注射器芯向里推(加压)或向外拉(减压)时,则可从注射器前部正面观察(注2)到注射器内部气体颜色的变化。从而演示出压力对平衡的影响。另外,在实验前可将一白色瓷板放到注射器芯的前面作为衬底,从而使观察注射器内气体颜色变化更明显,加强了演示的效果。
思考题:演示压力对平衡的影响时,为什么要从注射器前部正面观察?
注1:N2O4由固体Pb(NO3)2热分解制得的。具体方法如下:将固体Pb(NO3)2和石英砂混合后加到硬质玻璃管理,用管式炉或电热丝加热,制取的NO2气体通过P2O5干燥,并以盐-冰水体系冷却至-11℃以下,得到液态的N2O4,用安瓶盛装。
注2:有的文献记载由侧面观察,这是错误的。因为增大压力时,即使平衡未移动,当气体体积缩小时,气体的密度增加,颜色必然加深。本来加压时因平衡移动气体颜色应变浅,但同时气体的密度增加又使颜色变深,两种因素综合可能得到变深的结论。如从正面观察,密度增加这一干扰因素可以消除。例如压力增加一倍则体积缩小一半,气层厚度为原来的![]() ,但气体密度为原来的2倍,颜色加深2倍。即气体颜色变深,但气层厚度变薄,故两种因素抵消。
,但气体密度为原来的2倍,颜色加深2倍。即气体颜色变深,但气层厚度变薄,故两种因素抵消。

