第五章 化学平衡
 知识点一:化学反应的方向和限度
知识点一:化学反应的方向和限度
一、摩尔反应吉布斯自由能和平衡的条件
设在封闭系统中有一反应
若在等温等压条件下,上述反应发生了微小的变化(也即反应进度为d![]() ),系统内吉布斯自由能的变化应为
),系统内吉布斯自由能的变化应为
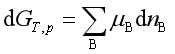 (1)
(1)
因为 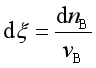
所以 ![]()
将此关系代入式(1)得
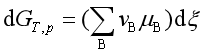 (2)
(2)
式(2)可写成
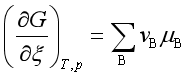 (3)
(3)
或
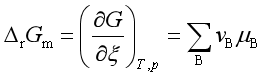 (4)
(4)
![]() 表示在等温等压条件下,上述反应按计量方程进行了一个单位的反应进度时(即
表示在等温等压条件下,上述反应按计量方程进行了一个单位的反应进度时(即![]() =1 mol时)引起反应的吉布斯自由能变化,原则上它可以通过式(4)由参加反应的各物质化学势的代数和来计算。但是,参与反应的各物质的化学势
=1 mol时)引起反应的吉布斯自由能变化,原则上它可以通过式(4)由参加反应的各物质化学势的代数和来计算。但是,参与反应的各物质的化学势![]() 与浓度有关,在整个反应过程中(即
与浓度有关,在整个反应过程中(即![]() 自0变到1mol),
自0变到1mol),![]() 都是变化的,除非反应系统无限大,
都是变化的,除非反应系统无限大,![]() 可视为不变。因此,只有在无限大量的反应系统中,
可视为不变。因此,只有在无限大量的反应系统中,![]() 才表示等温等压条件下,进行一个单位反应进度时系统吉布斯自由能的改变。称
才表示等温等压条件下,进行一个单位反应进度时系统吉布斯自由能的改变。称![]() 为摩尔反应吉布斯自由能(变),其单位是J·mol-1。
为摩尔反应吉布斯自由能(变),其单位是J·mol-1。
若在有限量的反应系统中,式(4)表示等温等压及反应进度为![]() 时,再进行
时,再进行![]() (
(![]() →0)反应时(此时
→0)反应时(此时![]() 也可以看作不变),系统的吉布斯自由能改变
也可以看作不变),系统的吉布斯自由能改变![]() 为摩尔反应吉布斯自由能
为摩尔反应吉布斯自由能![]() 。由式(4)可知:
。由式(4)可知:
若![]()
![]() 0,即
0,即
![]() 0 ,或
0 ,或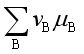
![]() 0,表示在指定的温度
0,表示在指定的温度![]() 、压力
、压力![]() 及反应进度
及反应进度![]() 时反应能自发地自左向右进行。
时反应能自发地自左向右进行。
若![]()
![]() 0,即
0,即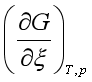
![]() 0 ,或
0 ,或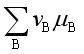
![]() 0,表示在指定的温度
0,表示在指定的温度![]() 、压力
、压力![]() 及反应进度
及反应进度![]() 时反应不能自发地自左向右进行。
时反应不能自发地自左向右进行。
若![]() =0,即
=0,即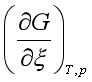 = 0 ,或
= 0 ,或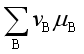 = 0,表示反应在指定的温度
= 0,表示反应在指定的温度![]() 、压力
、压力![]() 及反应进度
及反应进度![]() 时,反应达到平衡。
时,反应达到平衡。
所以,一定温度、压力下的化学反应的平衡条件是![]() ,或
,或 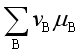 =0。在得到此结论时,未对系统作任何假设,所以此结论适用于等温、等压下任意系统的化学反应。
=0。在得到此结论时,未对系统作任何假设,所以此结论适用于等温、等压下任意系统的化学反应。
由上面讨论可知,要使反应自发地自左向右进行,产物的化学势之和必须小于反应物的化学势之和,这样,反应将一直进行到底,直至反应物全部变成产物(![]() =1mol),系统的化学势最低为止。但是,实际上绝大多数反应进行到一定程度(
=1mol),系统的化学势最低为止。但是,实际上绝大多数反应进行到一定程度(![]() 在0与1mol之间)便达平衡,这是为什么呢?
在0与1mol之间)便达平衡,这是为什么呢?
二、化学平衡的热力学原因
设有一理想气体反应A![]() B。初始时A物质的量为
B。初始时A物质的量为![]() ,B物质的量为0。当反应进行到反应进度为
,B物质的量为0。当反应进行到反应进度为![]() 时,A物质的量为
时,A物质的量为![]() ,B物质为
,B物质为![]() 。此时系统的吉布斯自由能由集合公式可得。
。此时系统的吉布斯自由能由集合公式可得。
即
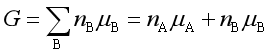
=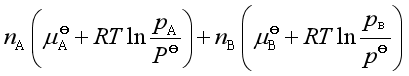
设反应系统的总压是![]() ,由道尔顿分压定律,可得
,由道尔顿分压定律,可得
所以 ![]() =
=![]()
![]() ,
, ![]() =
=![]()
![]()
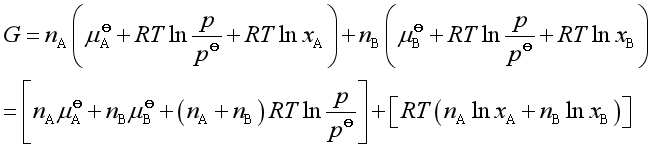
上式右边第一个方括弧内表示A、B两种气体各自在压力为![]() 的纯态时吉布斯自由能之和
的纯态时吉布斯自由能之和![]() ,第二个方括弧表示物质的量为
,第二个方括弧表示物质的量为![]() 的A气体与
的A气体与![]() 的B气体在等温等压混合时的混合吉布斯自由能变
的B气体在等温等压混合时的混合吉布斯自由能变![]() 。由此,上式可表示为
。由此,上式可表示为
为讨论方便,设![]() ,当反应进度为ξ时,
,当反应进度为ξ时,![]() =1
=1![]() -ξ而
-ξ而![]() =ξ,所以
=ξ,所以
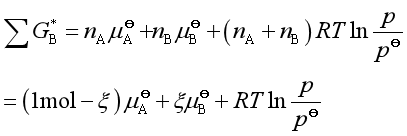
若设系统的总压维持![]() ,则
,则
在等温下, ![]() ,
,![]() 均为定值。故上式是个直线方程,即
均为定值。故上式是个直线方程,即![]() 与ξ成直线关系,如图1中线Ⅰ所示。
与ξ成直线关系,如图1中线Ⅰ所示。
其值与ξ的关系如图1中的线Ⅱ所示。
因![]() 与
与![]() 均小于1,所以
均小于1,所以![]() ,导致系统的吉布斯自由能G总是低于
,导致系统的吉布斯自由能G总是低于![]() ,
,
系统的吉布斯自由能G=![]() +
+![]() ,其值与ξ的关系如图1中线Ⅲ所示。由图可知,线Ⅲ的最低点就是系统的平衡态,此时
,其值与ξ的关系如图1中线Ⅲ所示。由图可知,线Ⅲ的最低点就是系统的平衡态,此时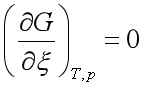 ,对应的
,对应的![]() 是在0与1mol 之间的某一值。
是在0与1mol 之间的某一值。
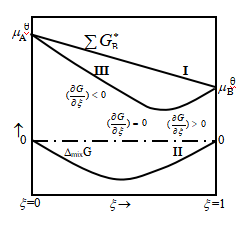
图1 反应过程中系统吉布斯自由能的改变
可见,当反应一旦有产物生成时,系统的吉布斯自由能就由两部分构成,![]() 和
和![]() 。由于混合吉布斯自由能的存在,且其值总是负值,所以整个系统的吉布斯自由能G在
。由于混合吉布斯自由能的存在,且其值总是负值,所以整个系统的吉布斯自由能G在![]() =0→1mol之间的某一值时为最小,而非
=0→1mol之间的某一值时为最小,而非![]() =1mol时最小。这就是多数化学反应总是存在平衡而不能进行到底的根本原因。
=1mol时最小。这就是多数化学反应总是存在平衡而不能进行到底的根本原因。
但是,如果在敞开系统中进行碳酸钙分解成CaO和CO2(g)的反应 ,由于CaCO3和CaO不形成固溶体,因此![]() =0,故此反应能进行到底,即
=0,故此反应能进行到底,即![]() =1mol。类似的情况还有溶液中形成沉淀的反应。
=1mol。类似的情况还有溶液中形成沉淀的反应。
