第五章 化学平衡
 知识点四: 平衡常数的热力学计算
知识点四: 平衡常数的热力学计算
有些化学反应速度快,很难达到平衡,有的反应条件比较难控制,要在平衡态下测其浓度很困难,因此,利用热力学数据求平衡常数的方法就很重要了。
由式![]() 可知,只要得到反应的标准摩尔反应吉布斯自由能
可知,只要得到反应的标准摩尔反应吉布斯自由能![]() ,就可计算
,就可计算![]() 。因此,用热力学方法计算
。因此,用热力学方法计算![]() ,首先要计算出反应的
,首先要计算出反应的![]() 。
。
一、由化合物的标准生成吉布斯自由能计算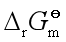
化学势的绝对值是无法计算的。因此,无法用 来计算
来计算![]() 。为此,与计算化学反应的标准摩尔反应焓类似,规定:一定温度下,由稳定单质生成
。为此,与计算化学反应的标准摩尔反应焓类似,规定:一定温度下,由稳定单质生成![]() 的物质B的标准摩尔吉布斯自由能变化,称为物质B的标准摩尔生成吉布斯自由能
的物质B的标准摩尔吉布斯自由能变化,称为物质B的标准摩尔生成吉布斯自由能![]() 。
。
例如,298.2K时有
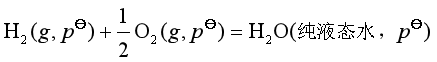
这是一个各物质都处于标准态下的生成反应,此反应的标准摩尔吉布斯自由能![]() ,就是液态水的标准摩尔生成吉布斯自由能
,就是液态水的标准摩尔生成吉布斯自由能![]() 。
。
常见化合物在298.2K时的标准摩尔生成吉布斯自由能都已经测定,在书后附录中和其他物理化学手册上可以查到,而常见的离子也有标准生成吉布斯自由能,水溶液中各离子的![]() 将在电化学中涉及。
将在电化学中涉及。
有了常见化合物在298.2K时的标准摩尔生成吉布斯自由能,就可以计算任一个化学反应在298.2K时的标准摩尔反应吉布斯自由能![]() (298.2 K),再由吉布斯-亥姆霍斯方程可算得任一个温度下反应的
(298.2 K),再由吉布斯-亥姆霍斯方程可算得任一个温度下反应的![]() (
(![]() ),从而计算得到任一个温度下反应的平衡常数
),从而计算得到任一个温度下反应的平衡常数![]() (
(![]() )。
)。
与![]() 计算
计算![]() 类似,由化合物
类似,由化合物![]() 计算反应的
计算反应的![]() ,可用下述公式
,可用下述公式
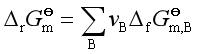
例5.3 298.2 K,100![]() 下,反应①
下,反应①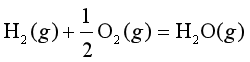 的
的![]() =-228. 59 kJ·mol-1,已知此温度下水的饱和蒸汽压是3.17 kPa, 水的密度是9970 kg·m-3,求298.2 K,100 kPa下反应②
=-228. 59 kJ·mol-1,已知此温度下水的饱和蒸汽压是3.17 kPa, 水的密度是9970 kg·m-3,求298.2 K,100 kPa下反应②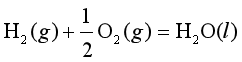 的
的![]() ,并估算此反应在常温下能否进行。
,并估算此反应在常温下能否进行。
解 按题意,要求反应②的![]() 其含义是
其含义是
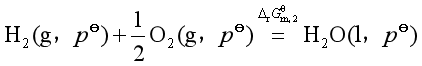
与已知反应①联系起来,可设计如下过程
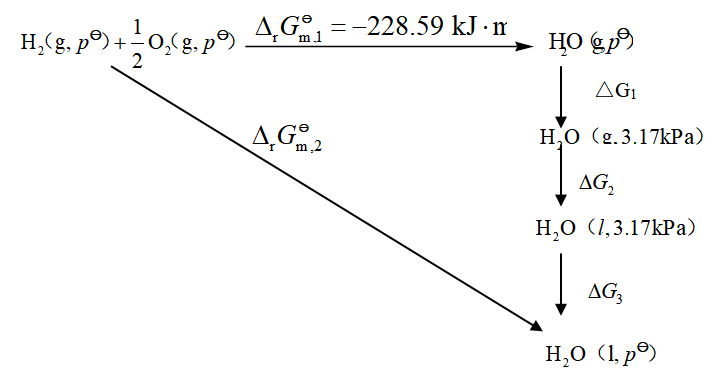
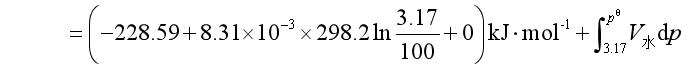
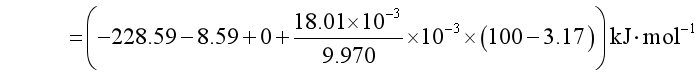
因![]() ,故反应在常温下能进行。
,故反应在常温下能进行。
二、由反应的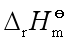 及
及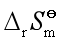 计算
计算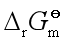
由于化学反应在等温下进行时有
其中![]() 是化学反应的标准摩尔反应焓,可由参加反应物质的标准摩尔生成焓或标准摩尔燃烧焓等热力学数据算出。
是化学反应的标准摩尔反应焓,可由参加反应物质的标准摩尔生成焓或标准摩尔燃烧焓等热力学数据算出。![]() 是化学反应的标准摩尔熵变,可由参加反应物质的标准摩尔墒值计算得到,从而可计算298.2K时
是化学反应的标准摩尔熵变,可由参加反应物质的标准摩尔墒值计算得到,从而可计算298.2K时![]() 的值。若反应不是在298.2K下进行,则应先算出所求温度时的
的值。若反应不是在298.2K下进行,则应先算出所求温度时的![]() 及
及![]() ,然后算得该温度的
,然后算得该温度的![]() ,再由此计算该温度时的
,再由此计算该温度时的![]() 。
。
例4 根据下列数据求反应
C2H4(g)+H2(g)= C2H6 (g)
在1000K时的![]() ,已知:(1)298K时,乙烯和乙烷的
,已知:(1)298K时,乙烯和乙烷的![]() 分别为-1411 kJ·mol-1和-1560 kJ·mol-1,液态水的标准生成焓是-286 kJ·mol-1;(2)298K时,C2H4(g),C2H6 (g)和H2(g)的
分别为-1411 kJ·mol-1和-1560 kJ·mol-1,液态水的标准生成焓是-286 kJ·mol-1;(2)298K时,C2H4(g),C2H6 (g)和H2(g)的![]() 分别为219.5 J·K-1·mol-1,229.5 J·K-1·mol-1和130.6kJ·K-1·mol-1;(3)在298K→1000K的范围内,反应的平均热容差
分别为219.5 J·K-1·mol-1,229.5 J·K-1·mol-1和130.6kJ·K-1·mol-1;(3)在298K→1000K的范围内,反应的平均热容差![]() =-19.71kJ·K-1·mol-1
=-19.71kJ·K-1·mol-1
解 液态水的标准生成焓即为氢气的标准燃烧焓,所以
![]()
![]()
![]()
![]()
![]()
![]()
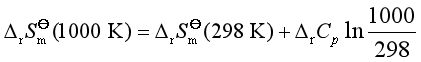
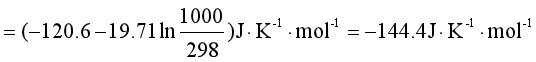
![]()
![]()
则 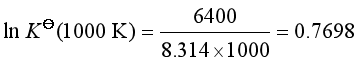
解得 ![]()
三、由可逆电池的电动势计算
若将化学反应安排成可逆电池,在等温等压下测定其电动势E和反应物的浓度,从而求得标准电动势,由![]() ,即可得
,即可得![]() 。这一部分将在电化学中讨论。
。这一部分将在电化学中讨论。
