第五章 化学平衡
 知识点五:各种因素对化学平衡的影响
知识点五:各种因素对化学平衡的影响
一、温度对平衡常数的—范荷夫等压式
将第二章讨论的吉布斯-亥姆霍斯方程用于化学反应可得
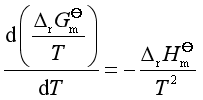 (34)
(34)
把![]() 代入上式有
代入上式有
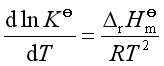 (35)
(35)
式(35)就是标准平衡常数与温度关系的微分式,称为范荷夫方程式。式中![]() 是标准反应平衡常数,
是标准反应平衡常数,![]() 是该反应的标准摩尔反应焓,它可由参加反应物质的标准摩尔生成焓计算得到。由范荷夫方程式可知
是该反应的标准摩尔反应焓,它可由参加反应物质的标准摩尔生成焓计算得到。由范荷夫方程式可知
若![]() >0,即吸热反应。则
>0,即吸热反应。则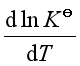 >0,说明平衡常数随温度升高而增大,平衡右移,有利于反应正向进行。
>0,说明平衡常数随温度升高而增大,平衡右移,有利于反应正向进行。
若![]() <0,即放热反应,则
<0,即放热反应,则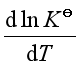 <0,说明平衡常数随温度升高而减小,平衡左移,不利于反应正向进行。
<0,说明平衡常数随温度升高而减小,平衡左移,不利于反应正向进行。
由范荷夫方程式的微分式可推得范荷夫方程的积分式。
(1)若温度变化不大,![]() 可当作常数,将
可当作常数,将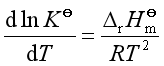 式作不定积分,可得
式作不定积分,可得
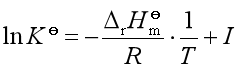 (36)
(36)
此式说明![]() 与
与![]() 成直线关系,直线的斜率为
成直线关系,直线的斜率为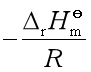 。
。
若作定积分可得
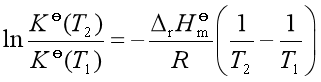 (37)
(37)
(2)若温度变化范围较大,![]() 不能当作常数,这种情况一般只讨论其不定积分式。
不能当作常数,这种情况一般只讨论其不定积分式。
根据基尔霍夫公式的不定积分式为
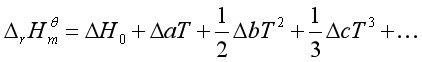
代入(35)得
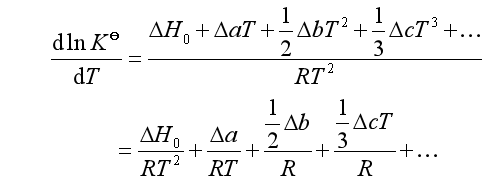
积分上式得
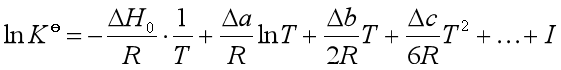
式中![]() 和
和![]() 都是积分常数,此式就是
都是积分常数,此式就是![]() 与温度的具体函数形式。所以
与温度的具体函数形式。所以
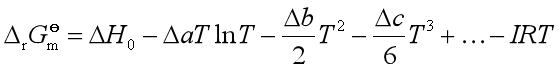
当![]() 不是常数时,有一个特殊情况,若题给各物的热容是平均热容,此时
不是常数时,有一个特殊情况,若题给各物的热容是平均热容,此时![]() =定值。
=定值。
即 ![]()
代入式(35),作不定积分得
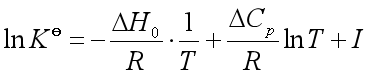 (38)
(38)
或
![]() (39)
(39)
二、压力对反应平衡移动的影响
由前面的讨论已知标准平衡常数![]() 仅是温度的函数。因此,一定温度下压力对化学平衡的影响,实际上并非是对平衡常数
仅是温度的函数。因此,一定温度下压力对化学平衡的影响,实际上并非是对平衡常数![]() 的影响,而是指对平衡移动的影响。并且,这种对平衡移动的影响主要是指对气相反应(设气相为理想气体)而言,对凝聚反应影响很小。
的影响,而是指对平衡移动的影响。并且,这种对平衡移动的影响主要是指对气相反应(设气相为理想气体)而言,对凝聚反应影响很小。
由于理想气体反应的平衡常数中,只有![]() 与压力有关,而
与压力有关,而![]() 表示的是平衡时气体的组成,故通过压力对
表示的是平衡时气体的组成,故通过压力对![]() 的影响就能说明压力对气相反应平衡移动的影响。
的影响就能说明压力对气相反应平衡移动的影响。
已知理想气体反应![]() 与
与![]() 的关系为
的关系为![]() ,取对数得
,取对数得
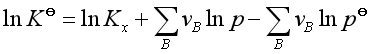
式中p为系统总压。将上式在等温下对压力求导得
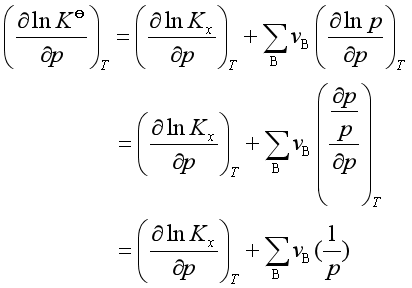
等温下,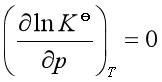
所以 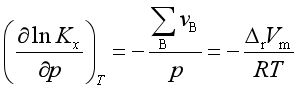 (40)
(40)
式中![]() 是反应系统的总压,
是反应系统的总压,![]() 是单位反应中产物的体积与反应物的体积之差。
是单位反应中产物的体积与反应物的体积之差。
由式(5.40)可见,等温下平衡组成与压力有关。当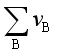 >0时,
>0时,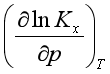 <0,即对于反应分子数增加的反应而言,压力升高不利于平衡右移。当
<0,即对于反应分子数增加的反应而言,压力升高不利于平衡右移。当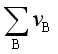 <0时,
<0时,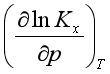 >0,即对于反应分子数减少的反应而言,压力升高有利于平衡右移,这与吕查德里原理吻合,即增大压力,反应向分子数减少的方向移动。
>0,即对于反应分子数减少的反应而言,压力升高有利于平衡右移,这与吕查德里原理吻合,即增大压力,反应向分子数减少的方向移动。
对凝聚相反应而言,因为反应前后体积改变很小,故压力对平衡移动的影响可以忽略。
三、惰性气体对平衡的影响
由于压力影响气相反应的平衡组成,所以如果在反应系统中加入惰性气体,会改变各组分压力,必将改变平衡组成,这就是惰性气体对平衡的影响。所谓惰性气体指的是不参与反应的物质,例如水蒸气在乙苯脱氢制苯乙烯反应中就是惰性气体,CH4在氨合成反应中也是惰性气体。
惰性气体对反应的影响可分为两种情况:
(1)在保持系统总压不变下加入惰性气体。
因为 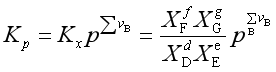
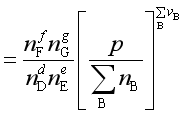 (41)
(41)
在加入惰性气体时,由于总压不变,而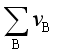 加大,若
加大,若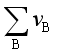 >0,
>0,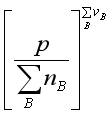 必定减小,为了维持
必定减小,为了维持![]() 不变,
不变,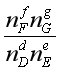 必然增大,即反应向右移动。即惰性气体加入对反应分子数增加的反应是有利的。如在乙苯脱氢制苯乙烯过程中常加入水蒸气以利平衡产率增高。也可以这样来理解惰性气体的影响:由于总压不变,惰性气体的加入相当于有效成分总压的降低,当然有利于反应分子数增加的反应。
必然增大,即反应向右移动。即惰性气体加入对反应分子数增加的反应是有利的。如在乙苯脱氢制苯乙烯过程中常加入水蒸气以利平衡产率增高。也可以这样来理解惰性气体的影响:由于总压不变,惰性气体的加入相当于有效成分总压的降低,当然有利于反应分子数增加的反应。
如果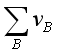 <0时,增加惰性气体必然导致平衡左移,不利于产物生成,因此在反应系统中要设法清除这些惰性气体。例如在用天然气作原料合成氨过程中的惰性气体,为了不降低产率,在生产中定时在原料进入合成塔前释放一部分循环原料气,以降低系统中惰性气体的百分数来提高产率。这一部分释放气中含有大量可燃的CH4和H2,一般可输送到厂生活区作燃料用。
<0时,增加惰性气体必然导致平衡左移,不利于产物生成,因此在反应系统中要设法清除这些惰性气体。例如在用天然气作原料合成氨过程中的惰性气体,为了不降低产率,在生产中定时在原料进入合成塔前释放一部分循环原料气,以降低系统中惰性气体的百分数来提高产率。这一部分释放气中含有大量可燃的CH4和H2,一般可输送到厂生活区作燃料用。
(2)若在等温和等容下加入惰性气体,也即加入惰性气体时使系统的总压作相应的变化,则惰性气体的加入不会影响平衡组成。
因为式(5.41)可写作:
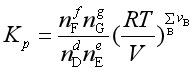
例5 NaHCO3的分解反应:![]() ,实际测定的分解压力在30℃时为
,实际测定的分解压力在30℃时为![]() ,110℃时为
,110℃时为![]() ,若反应焓与温度无关,试求:
,若反应焓与温度无关,试求:
(1)平衡常数![]() 与
与![]() 的关系式;
的关系式;
(2)NaHCO3在常压下的分解温度;
(3)反应的![]() ;
;
(4)恒压下通入惰性气体对平衡有何影响?
解(1)由NaHCO3的分解反应式可知,在某温度下反应达平衡后![]() ,分解压
,分解压![]() 为
为
![]() ,其平衡常数
,其平衡常数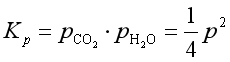
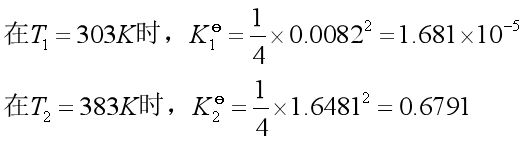
将以上两式代入等压式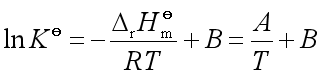 中,得
中,得
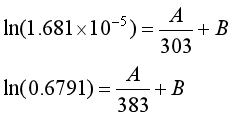
解得 ![]() ,
,![]() 。
。
所以![]() 与
与![]() 的关系式为
的关系式为 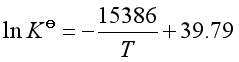 (1)
(1)
(2)常压指在![]() 下,即分解压力
下,即分解压力![]()
由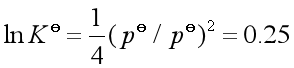 代入(1)所得结论得
代入(1)所得结论得
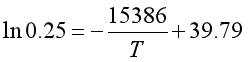
从而解得常压下NaHCO3的分解温度为![]() 。
。
(3)由 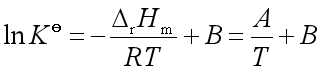
所以 ![]()
(4)通入惰性气体后,平衡向右移动。
