一、填空题
1、反应的摩尔吉布斯自由能![]() 的定义式是:
的定义式是:![]() ,它与标准摩尔吉布斯自由能(变)
,它与标准摩尔吉布斯自由能(变)![]() 的关系是:
的关系是:![]()
![]()
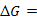 。
。
2、封闭系统中进行的化学反应:![]() 。在反应过程中,
。在反应过程中,![]() 和
和![]() 两者间形成了 ,使反应系统的吉布斯自由能G随反应进度
两者间形成了 ,使反应系统的吉布斯自由能G随反应进度![]() 变化的曲线(G—
变化的曲线(G—![]() )上存在一个 点,此点是化学平衡的位置。
)上存在一个 点,此点是化学平衡的位置。
3、理想气体反应经验平衡常数![]() 与
与![]() 、
、![]() 的关系分别为:
的关系分别为:![]()
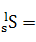
![]() ;
;![]()
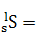
![]() 。
。
4、按化学反应等温方程式,当![]()
![]() 时,则
时,则![]() 0,反应正向自发进行。
0,反应正向自发进行。
5、对理想气体反应: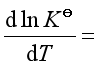 ,
,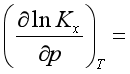 。
。
6、理想气体反应:![]() 在封闭容器中进行,在等温等压下通入惰性气体,平衡 移动;在等温等容下通入惰性气体,平衡 移动。
在封闭容器中进行,在等温等压下通入惰性气体,平衡 移动;在等温等容下通入惰性气体,平衡 移动。
7、将反应:![]() 的标准平衡常数
的标准平衡常数![]() 对 作图,可得一条直线,直线的斜率为 。
对 作图,可得一条直线,直线的斜率为 。
8、标准平衡常数![]() 与
与![]() 之间的关系为 ;对理想气体反应而言,
之间的关系为 ;对理想气体反应而言,![]() 与经验平衡常数
与经验平衡常数![]() 二者之间的关系是 。
二者之间的关系是 。
9、反应![]() 的分解温度是指 等于外压(常为
的分解温度是指 等于外压(常为![]() )时的温度。转折温度是指 时所对应的温度。
)时的温度。转折温度是指 时所对应的温度。
10、计算化学反应的![]() ,可以查表,利用参加反应物质的 吉布斯自由能,其计算公式(通式)为 。
,可以查表,利用参加反应物质的 吉布斯自由能,其计算公式(通式)为 。
二、判断题(对者写“√”,错者写“×”)
1、反应的摩尔吉布斯自由能![]() 是反应产物与反应物之间的吉布斯自由能的差值。
是反应产物与反应物之间的吉布斯自由能的差值。
2、在恒定的温度和压力条件下,某化学反应的![]() 就是在一定量的系统中进行1 mol的化学反应时产物与反应物之间的吉布斯自由能的差值。
就是在一定量的系统中进行1 mol的化学反应时产物与反应物之间的吉布斯自由能的差值。
3、因为![]() ,所以
,所以![]() 是平衡状态时的吉布斯自由能变化。
是平衡状态时的吉布斯自由能变化。
4、![]() 的大小表示了反应系统处于该反应进度
的大小表示了反应系统处于该反应进度![]() 时反应的趋势。
时反应的趋势。
5、任何一个化学反应都可以用![]() 来判断其反应进行的方向。
来判断其反应进行的方向。
6、标准平衡常数的数值不仅与方程式的写法有关,而且还与标准态的选择有关。
7、因![]() 只是温度的函数,所以对于理想气体的化学反应,当温度一定时,其平衡组成也一定。
只是温度的函数,所以对于理想气体的化学反应,当温度一定时,其平衡组成也一定。
8、理想气体反应![]() 在一定温度下达平衡,保持体积不变,
在一定温度下达平衡,保持体积不变,
通入N2(g)使压力增大一倍,可使![]() 的解离度减小。
的解离度减小。
9、当CaCO3(s)处于分解温度时,其标准平衡常数![]() 。
。
10、某分解反应为:![]() ,则其
,则其![]() 与解离压力(分解压)p之间的关系式为:
与解离压力(分解压)p之间的关系式为: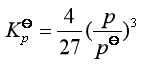 。
。
三、单项选择题(下列各题的4个选项中,只有1个正确答案)
1、化学反应若严格遵循系统的“摩尔吉布斯自由能-反应进度”的曲线进行,则该反应最终处于
A、曲线的最低点 B、起始点与最低点之间
C、终了点与最低点之间 D、曲线上的每一点
2、对于摩尔反应吉布斯自由能 ∆rGm,下列理解错误的是
A、∆rGm是在T、p、ξ一定的条件下,进行一个单位反应时吉布斯自由能的改变
B、∆rGm是在有限反应系统终态和始态吉布斯自由能的差值,即实际过程的∆G
C、∆rGm是指定条件下,反应自发进行趋势的量度,∆rGm < 0,反应自发向右进行
D、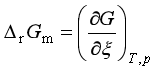 ,等于G~ξ图中反应进度为ξ时的曲线斜率
,等于G~ξ图中反应进度为ξ时的曲线斜率
3、设反应 A(s) = D(g) + G(g) 的∆rGm /J·mol-1 = -4500 + 11T/K,要防止反应发生,温度必须
A、高于409 K B、低于136 K
C、高于136 K而低于409 K D、低于409 K
4、有一理想气体反应 A + B = 2C ,在某一定温度下进行,按下列条件之一可以用![]() 直接判断反应方向和限度
直接判断反应方向和限度
A、任意压力和组成
B、总压101.325 kPa
C、总压303.975 kPa ,xA = xB = xC = ⅓
D、总压405.300 kPa ,xA = xB = ¼ ,xC = ½
5、反应C(s) + 2H2(g)=CH4(g) 在1000 K时的![]() = 19.29 kJ·mol-1。当总压为100 kPa,
= 19.29 kJ·mol-1。当总压为100 kPa,
气相组成是:H2 70%、CH4 20%、N2 10% 的条件下,上述反应
A、正向进行 B、逆向进行 C、平衡 D、不一定
6、已知下列反应的平衡常数
① H2(g) + S(s) = H2S(s) K1 ; ② S(s) + O2(g) = SO2(g) K2 。
则反应 H2(g) + SO2(g) = O2(g) + H2S(g) 的平衡常数为
A、K1 + K2 B、K1 - K2 C、K1·K2 D、K1/K2
7、恒温下某氧化物分解反应:AO2(s) = A(s) + O2(g) 的平衡常数为 Kp(1),若反应
2AO2(s) = 2A(s) + 2O2(g) 的平衡常数为 Kp(2),则
A、Kp(1) > Kp(2) B、Kp(1) < Kp(2)
C、Kp(1) = Kp(2) D、有的 Kp(1) > Kp(2),有的 Kp(1) < Kp(2)
8、对于同一化学反应,反应式写法不同,例如(1)N2 + 3H2 = 2 NH3;
(2)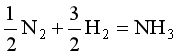 。则下列叙述正确的是
。则下列叙述正确的是
A、∆rGm不变 B、Kp不变
C、![]() 不变 D、
不变 D、![]() ,正向自发
,正向自发
9、下列叙述中不正确的是
A、标准平衡常数仅是温度的函数
B、催化剂不能改变平衡常数的大小
C、平衡常数发生变化,化学平衡必定发生移动,达到新的平衡
D、化学平衡发生新的移动,平衡常数必发生变化
10、对于理想气体反应,下列标准摩尔反应自由能与平衡常数之间的关系式中正确的是
A、![]() B、
B、![]()
C、![]() D、
D、![]()

