当前位置:课程学习>>第六章 化学动力学基础>>知识讲解>>视频课堂>>知识点五
知识点五:温度对反应速率的影响
四、表观活化能
反应活化能存在的事实表明,反应系统中不是所有的分子都能参与反应,只有少数具有一定能量水平的分子才能引起反应,这种分子称为活化分子。活化分子的平均能量与所有分子平均能量之差称为活化能。1925年,托尔曼![]() :
:
![]()
即活化能是活化分子的平均能量与反应物分子的平均能量之差。
对于基元反应活化能有明确的物理意义。对于复合反应,![]() 是各基元反应活化能的特定组合,称为表观活化能。
是各基元反应活化能的特定组合,称为表观活化能。
例如:![]()
![]()
反应机理为:
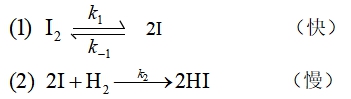
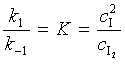 ,
, 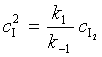
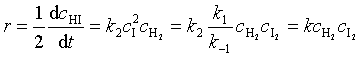
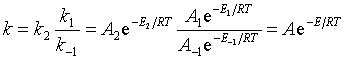
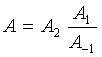
![]()
![]()
【练习题】对平行反应: ![]()
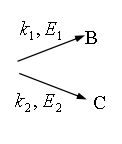 ,试导出表观活化能
,试导出表观活化能 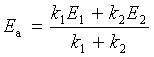
五、活化能与温度的关系
许多反应按阿氏公式,以lnk对1/T作图不是直线,表明Ea不是常数,与温度有关。
1893年,柯奇将阿伦尼乌斯公式修正为:
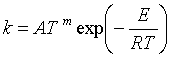
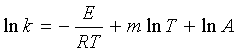
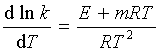
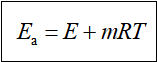
当![]() >>
>>![]() 时,
时,![]() ≈
≈![]() ,上式表明了
,上式表明了![]() 与温度的定量关系。
与温度的定量关系。
接下来让我们进行下一部分的学习
