知识点八:反应速率理论
二、过渡状态理论
1、理论要点:化学反应不是只通过简单的碰撞就变成产物,当反应物分子相互接近时,价键要经过重排,能量需重新分配,即经过一个过渡状态,处于过渡状态的反应系统称为活化络合物,活化络合物与反应物分子之间建立化学平衡,总反应速率由活化络合物转变成产物的速率决定。
![]()
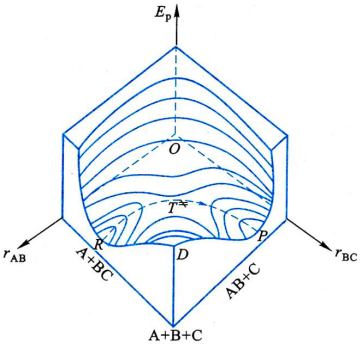
反应系统的势能![]() ,势能面取上面
,势能面取上面![]() 所示的途径为横坐标(反应坐标),则所得平面图为:
所示的途径为横坐标(反应坐标),则所得平面图为:
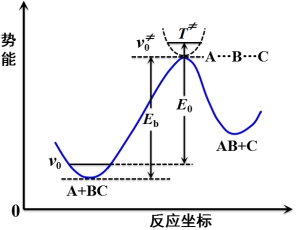
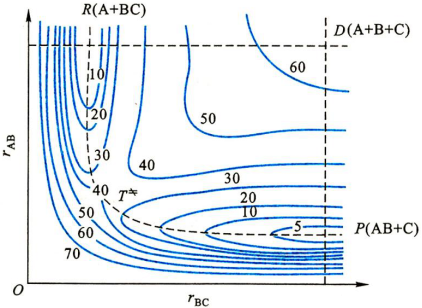
图中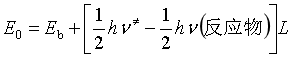
2、反应速率常数的计算
![]()
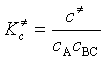 ,
,![]()
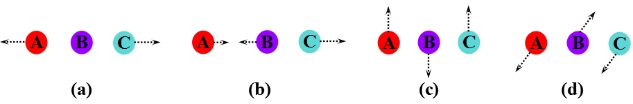
根据过渡状态理论的假设,活化络合物只在进行一次非对称伸缩振动就能断裂(发生反应),因此反应速率为
![]()
按量子力学及能量均分原理:
![]()
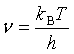
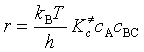
与二级反应速率方程:![]() 比较,得
比较,得
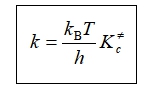 艾林方程
艾林方程
用热力学方法计算![]() :
:
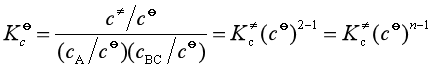
![]()
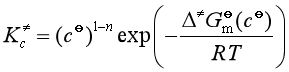
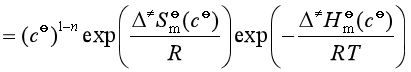
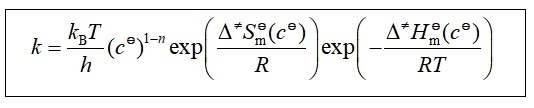
此式为过渡状态理论的热力学形式。
3、理论评价
成功之处:(1)将物质的微观结构与动力学性质联系起来,提供了理论上计算的可能性;(2)势能面、过渡状态、活化络合物等概念得到了广泛的应用。
不足之处:(1)理论带有猜测性;(2)活化络合物尚不能测定。
接下来让我们进行下一部分的学习
