演示实验:过氧化氢分解反应
一、演示方法
各取一支100mL量筒、250mL锥形瓶、玻璃盆等安装成如图所示的装置。在玻璃盆中装入水。用宽为1cm的白纸条贴在量筒外侧上,并把量筒装满水,倒置于水盆中,固定之。然后把50mg二氧化锰和100mL蒸馏水放在锥形瓶里。再把1 mL的30%过氧化氢倒入锥形瓶里,振荡几次。立即塞紧瓶口,每隔三分钟,用红墨水在白纸条上标出量筒里水面的位置。过十二分钟后,可以观察到量筒里水面移动的位置的间隔越来越小。这说明在二氧化锰的催化下,过氧化氢分解成水和氧气的速率随着反应体系中过氧化氢浓度的减少而逐渐减少。
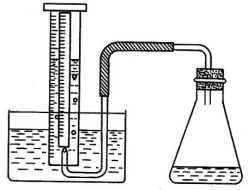
二、思考题
针对上面装置,设计一个求算过氧化氢分解反应速率常数![]() 和活化能
和活化能![]() 的方法。
的方法。
操作实验:“碘钟”反应动力学
一、实验原理
本实验以过硫酸根离子![]() 和碘离子
和碘离子![]() 的氧化还原反应为例,演示反应速率常数
的氧化还原反应为例,演示反应速率常数![]() 和活化能
和活化能![]() 的测定方法。其反应机理是:
的测定方法。其反应机理是:
![]() 慢
慢
![]() 快
快
总反应方程为:
![]()
反应速率由上述慢反应决定,则动力学方程式为:
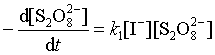
如果反应体系中碘离子是过量的,则:
![]()
代入上式得到一级反应动力学方程式:
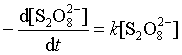
积分上式,得
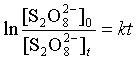
当反应进行到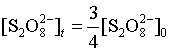 ,即
,即![]() 减少了
减少了![]() 时,则
时,则
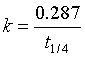
二、操作方法
取100mL大试管作为反应器,把20mL的![]() 碘化钾溶液和10mL的
碘化钾溶液和10mL的![]() 硫代硫酸钠溶液都倒入反应器中。另取100mL大试管,内装20mL的
硫代硫酸钠溶液都倒入反应器中。另取100mL大试管,内装20mL的![]()
![]() 过硫酸铵溶液和5mL的0.5%淀粉溶液(所有溶液都要新配制的),然后把过硫酸铵溶液倒入反应器中,搅拌的同时记下时间。当透明无色的反应物开始呈现蓝色时(注1),记下时间,便测得室温下的
过硫酸铵溶液和5mL的0.5%淀粉溶液(所有溶液都要新配制的),然后把过硫酸铵溶液倒入反应器中,搅拌的同时记下时间。当透明无色的反应物开始呈现蓝色时(注1),记下时间,便测得室温下的![]() 的数据。利用上式求反应速率常数
的数据。利用上式求反应速率常数![]() 和
和![]() 。
。
取1000mL烧杯,里面放三分之二的温水,使其水温![]() 略高于室温5℃左右。在此温水中重复上述实验测得
略高于室温5℃左右。在此温水中重复上述实验测得![]() 和
和![]() 。再计算反应的活化能
。再计算反应的活化能![]() (注2)。
(注2)。
注1:在所配制的反应液中,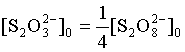 ,由于发生碘的还原反应
,由于发生碘的还原反应
![]()
因此,要经过![]() 的时间之后,
的时间之后,![]() 才耗尽。析出来的碘和淀粉作用使反应体系呈蓝色。
才耗尽。析出来的碘和淀粉作用使反应体系呈蓝色。
注2:活化能![]() 按下式计算:
按下式计算:

三、思考题:
(1)从定量实验的角度看,本实验的处理方法稍显简单,试设计一个更为精确的处理方法。
(2)若以H2O2取代过硫酸铵,也可进行上述实验。试设计实验方案实施演示。

