第六章 化学动力学基础
 知识点一:化学反应速率
知识点一:化学反应速率
一、反应速率
通常认为,反应物分子经碰撞后才可能发生反应,在一定温度下,化学反应的速率正比于反应分子的碰撞次数,而在单位体积中,单位时间内的碰撞次数又与反应物的浓度成正比,可见反应速率与反应物浓度直接相关,反应速率可以用参加反应的某一物质的浓度随时间的变化率来表示。
对于等容系统中进行的任意反应
![]()
反应物A、B的消耗速率rA 和rB 可表示为
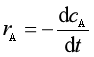 ,
, 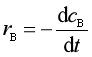 (1a)
(1a)
式中cA、cB为反应物A、B在t时刻的浓度,由于反应期间反应物浓度是减少的,![]() 、
、![]() 是负值,故在式子前加负号,以保证反应速率rA、rB 为正值。
是负值,故在式子前加负号,以保证反应速率rA、rB 为正值。
产物Y、Z的生成速率(rY、rZ)可表示为
 ,
, 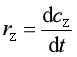 (1b)
(1b)
对于气相反应,由于压力比浓度容易测定,也可用参加反应各物质的分压来代替浓度。
应当注意的是,如果参加反应的各物质的化学计量数不相同,则各物质的浓度变化也不同,因而反应系统中用各物质浓度表示的反应速率之间的关系为
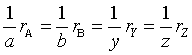
以上用物质的浓度变化表示反应速率的方法,必须指明反应方程式和被选用的物质。然而,若利用反应进度的概念,便可以对反应速率给出明确的定义。
设任意化学反应的计量式为
![]()
或写为
![]()
式中![]() 为反应方程式中任意物质B的化学计量数,对反应物取负值,对产物取正值。
为反应方程式中任意物质B的化学计量数,对反应物取负值,对产物取正值。
由于反应进度表示反应在不同时刻进行的程度,所以可以用单位时间内、单位体积中化学反应进度的变化来表示化学反应速率,其定义式为
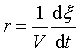 (2)
(2)
从该式可看出,反应速率r与参加反应的具体物质无关,但与反应方程式的写法有关。
因为 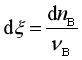
代入式(2)可得
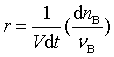
![]()
对于等容反应有
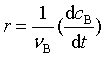
由此可得化学反应速率r与各物质浓度表示的反应速率rB之间的关系, 即
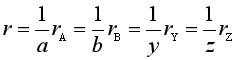 (3)
(3)
读者在学习过程中应注意区分r 和rB。
对于一些特殊的反应,如多相催化反应等,还会有不同的反应速率定义。
二、反应速率的测定
由反应速率的定义式(3)可知,测定反应速率实际是测定![]() ,通过测定并绘制不同时刻反应系统中某反应物或某产物浓度随时间的变化曲线(动力学曲线)如图1所示,再从图上求出不同反应时刻的
,通过测定并绘制不同时刻反应系统中某反应物或某产物浓度随时间的变化曲线(动力学曲线)如图1所示,再从图上求出不同反应时刻的![]() (即在t时刻曲线的切线斜率)值,就可以表示反应在t时刻的速率。图中,反应开始时的初速率为
(即在t时刻曲线的切线斜率)值,就可以表示反应在t时刻的速率。图中,反应开始时的初速率为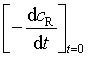 ,t1 时用产物和反应物表示的反应速率分别为
,t1 时用产物和反应物表示的反应速率分别为 ![]() 和
和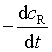 。
。
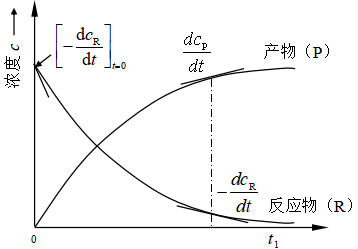
图1反应物和产物浓度随时间变化曲线
测定反应物(或生成物)在不同时刻的浓度可以用化学或物理的方法, 反应在到达平衡之前,反应系统中各物质的浓度时刻都在变化着,若用一般的化学分析方法测定浓度,取样时必须使化学反应立即停止在某个时刻,检测到的浓度才是该时刻的浓度。通常可采用骤冷、冲稀、加阻化剂或去催化剂等方法来 “冻结”反应进行,但这些方法比较繁琐,并容易产生误差。物理方法是利用某些与系统浓度有关的物理性质进行连续测定或快速测定,不但可以在线测定,而且易于数椐的自动采集和信息化处理。被测定的物理量有:压力、体积、旋光度、折光率、吸收光谱、电导率、热导率、介电常数、黏度、电动势等。
上述测定方法一般只适用于进行得不太快的化学反应,对于快速反应(如溶液中的酸碱中和等),由于反应进行的时间往往与混合时间相同甚至更短,这时,就要用特殊的方法进行测定,这将在后面讨论。
三、反应速率方程与反应级数
在恒定的温度下,反应速率通常是反应系统中某些物质浓度的函数,则反应速率r与物质浓度c的函数关系式称为化学反应的速率方程.。
例如三种卤化氢合成反应的速率与浓度有如下关系
H2 + I2 → 2HI ![]() (4)
(4)
H2 + Cl2 → 2HCl ![]() (5)
(5)
H2 + Br2 → 2HBr 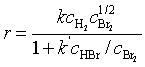 (6)
(6)
其中k、k´ 均为从实验得到的经验系数。上例说明,即使已知化学反应的计量方程式,一般也不能预言其速率方程的形式,不同的化学反应速率方程互不相同,人们可以通过实验来寻求反应速率方程式的形式,。这种函数关系式也称经验速率方程。
对于任意反应 aA + bB + …→ yY + zZ +…,速率方程可写为
![]()
上式是速率方程的微分式,若对该式在特定的条件下积分求解,可得另一种形式的速率方程,即它的积分形式,它表达了物质浓度与时间的关系。如
![]() ,
,![]() ……
……
人们常称速率方程的积分式为反应动力学方程,在实际工作中也常用到这种形式。
实验发现,速率方程常与反应物浓度的幂乘积成正比例。如某反应
aA + bB → yY + zZ
实验测定的反应速率可能是
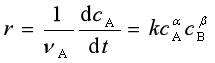 (7)
(7)
其中,k为反应速率系数,它是一个比例系数,等于各反应物浓度为1时的反应速率,因而k 的数值与各反应物浓度无关。对给定的反应,在一定的温度条件下k是一个常量。
反应速率系数也有两种表示方法,即反应速率系数k和某物质的反应速率系数kB,它们分别与反应速率的表示方法相对应,并由各种反应速率之间的关系式(3),可得各反应速率系数之间的关系为
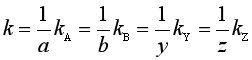 (8)
(8)
请读者注意,本章如不特别说明,所提及的反应速率系数k应该理解为与反应进度表示的速率对应的速率系数。
在反应速率方程式中,各物质浓度项的指数之代数和称为该反应的级数,用n表示,上式中n = α + β,其中,α和β分别称为物质A和B的级数。如从HI合成反应的速率方程式(式7.4)得之:反应对H2 为一级、对I2 也为一级,反应级数为二级。又如,从HCl合成反应的速率方程(式5)得之:反应对H2为一级、对Cl2为1/2级,反应级数为1.5级。
如果对速率方程进行分类,可分为:具有简单级数的速率方程(如HI合成、HCl合成的速率方程)和不具有简单级数的速率方程(如HBr合成的速率方程)。只有那些反应的速率方程能表示为幂乘积形式的(如式4、5),这些反应才有级数和速率系数,否则,就无级数和速率系数可言,如式(7.6)中的速率方程无级数,式中的k、k´ 也不称速率系数。
速率方程是根据实验事实来确定的,一般在测定前先设速率方程具有以下幂函数的形式: ![]() 实验任务是想办法测定k、α、β、γ等常量,若实验结果不能令人满意,则应考虑反应的速率方程不一定具有上式的形式,要另辟途径解决。
实验任务是想办法测定k、α、β、γ等常量,若实验结果不能令人满意,则应考虑反应的速率方程不一定具有上式的形式,要另辟途径解决。
