第六章 化学动力学基础
 知识点二:基元反应及质量作用定律
知识点二:基元反应及质量作用定律
一、基元反应、反应分子数
我们常见的一些化学反应,虽然形式上十分简单,但从化学动力学的观点看,往往是很复杂的。人们通常所写的化学方程式绝大部分并不代表反应的真正途径,而仅是代表反应的化学计量式。例如HCl气相合成反应,反应的计量式是
H2 + Cl2 → 2HCl (9a)
事实上,氯化氢的合成并不是通过氢分子和氯分子在一次化学碰撞中实现的,而是经历了一系列的反应完成的
Cl2 + M → 2Cl· + M (9b)
Cl· + H2 → HCl + H· (9c)
H· + Cl2 → HCl + Cl· (9d)
Cl· + Cl·+ M → Cl2 + M (9e)
式中M指反应器壁或其他第三体的分子(惰性物质,只起传递能量作用),方程式(9a)只表示一系列反应(9b)~(9e)的总结果。人们将能够在一次化学行为中完成的反应称为基元反应或元反应,像(9b)~(9e)这5个反应均属于基元反应。而表示总结果的(9a)是非基元反应,也称为总包反应或总反应。当总包反应只包含一个基元反应时,这样的总反应称为简单反应,反之,包含不止一种基元反应的总包反应称为复杂反应。复杂反应中的这些基元反应表示了反应经历的途径,也称反应机理或反应历程。
应该指出的是,参加化学反应及生成的任一物种(分子、原子、离子、自由基等)中的粒子,由于它们微观物理状态例如量子态、空间配置、运动速率及方向等各不相同,故实质上同一个基元反应又是由许多不同的基元化学物理反应所组成的,这种微观的基元化学物理反应即所谓态—态反应,原则上是用量子理论来进行研究。可见由微观的基元化学物理反应集合为宏观的基元反应,若干个基元反应结合为总包反应,这里包含了现象与本质的辩证统一关系。在本章中不介绍基元化学物理反应。
基元反应中反应物种的分子数目之和称为反应分子数。对于非基元反应,严格地讲不存在反应分子数这概念。分子数为1的基元反应称为单分子反应,例如处于激发态的孤立分子的异构化反应或分解反应
A* → P
上述基元反应(9b)、(9c)、(9d)反应分子数为二,也称双分子反应,而基元反应(9e)是三分子反应,基元反应的反应分子数在气相中一般不超过3,原因是许多分子同时在一次化学行为中的碰撞几率是极少的。除了类似(9e)的原子复合反应外,一般认为的三分子气相反应如下所示,也有报道认为其中的前三个反应不是基元反应,也就谈不上三分子反应了。
2NO + O2 → 2NO2
2NO + Cl2 → 2NOCl
2NO + Br2 → 2NOBr
I + I + H2 → 2HI
至今人们尚未发现气相的四分子反应。在液相中,由于分子间距很小及溶剂分子的存在,三分子反应较多见,但无论在气相或液相中,一般最常见的还是双分子反应。
二、质量作用定律
实验结果证明,基元反应的速率方程是有统一规律的,对于任意的基元反应
aA + bB → yY + zZ
其反应的速率方程为
![]() (10)
(10)
即在恒定的温度下,基元反应的速率与所有反应物浓度的幂乘积成正比,其中幂指数恰是反应式中各相应物质反应分子数。基元反应的这一规律称为质量作用定律,其中比例系数k 即反应速率系数。从反应级数以及基元反应分子数的定义可知,该基元反应的反应级数n =a+b,n也是该基元反应的反应分子数。
应注意的是,质量作用定律只适用于多组分均相系统的基元反应,因为只有这种系统才有“浓度”的概念,对于纯固体或纯液体,反应速率与浓度无关。
根据质量作用定律,很容易写出基元反应的速率方程。如对双分子基元反应
Br· + H2 → HBr + H·
速率方程可表示为 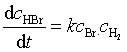
对三分子基元反应 I· + I· + M → I2 + M
速率方程为 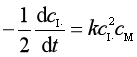
应特别指出,总包反应的速率方程中,经常也有反应速率与反应物浓度的幂乘积成正比的形式,但这与基元反应速率方程的质量作用定律形式有着本质的不同。总包反应的速率方程中幂指数之和是反应级数,是从实验得出的宏观量,不一定等于反应物的计量数之和。而对于基元反应,速率方程中幂指数之和是反应分子数,分子数反映了几个分子在反应历程中的微观行为。对于一个反应,其分子数是一个固定的数值,但反应级数却随反应条件的不同而可能有所改变。
由于简单反应只包含一个基元反应,故质量作用定律对简单反应也有效,此时它的反应物计量数之和为反应分子数且等于反应级数,但二者意义不同。另外,对于某些复杂反应,有时其速率方程在形式上也恰好符合质量作用定律,例如二叔丁基过氧化物的热分解反应
(CH3)3COOC(CH3)3 → (CH3)2CO + (CH3)3COCH3
实验得出其反应速率方程为![]() ,其形式虽与质量作用定律相符合,但事实上该反应却是一个由多个基元反应组成的复杂反应,故不能只从速率方程的形式判断反应是否为简单反应。
,其形式虽与质量作用定律相符合,但事实上该反应却是一个由多个基元反应组成的复杂反应,故不能只从速率方程的形式判断反应是否为简单反应。
三、反应机理
从上节可以看到,对于三种卤素I2、Cl2、Br2 与氢的合成反应,尽管它们的化学计量方程相似,但其速率方程却有很大的差异,其根本原因是由于它们的反应机理不同。从唯象的角度看,反应机理是指一总包反应所包含的各个基元反应的集合。
如 H2 + Cl2 → 2HCl 的反应机理即为 (9b)~(9e) 4个基元反应的集合,而溴化氢合成H2 + Br2 →2HBr 的反应机理是5个基元反应的集合
Br2 → 2 Br· (11a)
Br· + H2 → HBr + H· (11b)
H·+ Br2 → HBr + Br· (11c)
H·+ HBr → H2 + Br· (11d)
2Br· + M → Br2 + M (11e)
碘化氢的合成:H2+I2→2HI,长期以来人们认为只含一个与总包反应计量方程相同的基元反应,即所谓四元环机理。经进一步深入研究,认为碘化氢合成的机理至少包含以下三个基元反应
I2 + M → 2I·+ M (12a)
2I· + H2 → 2HI (12b)
2I· + M → I2 + M (12c)
可见,反应速率方程不同,反映了反应机理的差异,例如三种卤化氢的合成;速率方程相似,并不一定意味反应机理也相似。当反应机理深入到基元化学物理反应研究时,则称之为分子机理。
