第六章 化学动力学基础
 知识点四:典型复合反应
知识点四:典型复合反应
前面讨论了一些简单级数的反应,而实际上化学反应往往很复杂,经常是由二个或多个基元反应组合而成的。组成复杂反应的两个或多个基元反应以不同的形式和次序相互组合,比较典型的有对峙反应、平行反应、连串反应等。依据反应独立共存原理,即一基元反应的反应速率及其服从的基本动力学规律不因其他基元反应的存在与否而有所不同,人们可以借助研究基元反应的方法来处理复合反应的动力学问题。本节仅讨论最基本的复杂反应的动力学规律及特点。
一、对峙反应
在实验条件下,正向和逆向能同时进行的反应,称为对峙反应,也称可逆反应。这里的可逆反应仅是指反应可以双向进行之意,与热力学所述的“可逆”有本质上的不同。
现以最简单的1-1级对峙反应为例,讨论对峙反应速率方程的建立及其特点。
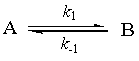
t = 0 a 0
t = t a - x x
t = te a – xe xe (下标e表示平衡)
在反应的任何瞬间t,产物B浓度随时间的变化率取决于正向及逆向反应的净结果。根据反应独立共存原理,可以写出包括两项之差的总反应速率方程
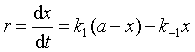 (36)
(36)
当反应达平衡时,反应系统中各物质的浓度不再随时间而变化,![]() ,根据式(36)得 k1(a-xe)=k-1xe ,即
,根据式(36)得 k1(a-xe)=k-1xe ,即
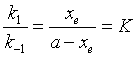 (37)
(37)
式中K为对峙反应的平衡常数,它等于正、逆反应速率系数之比。根据反应速率求得的平衡常数与热力学方法求得的平衡常数有所不同,后者与计量方程式的写法有关,而前者无关,对一定条件下的反应而言,其值是唯一的。平衡常数与速率系数关系对处于平衡状态的对峙反应具有普遍意义。
为了求得对峙反应的速率系数 k1与k-1 ,可做如下处理:从式(37)得
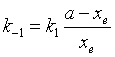 (38)
(38)
将式(38)代入式(36)得
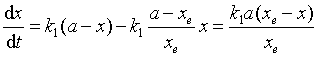 (7.39)
(7.39)
将式(39)作定积分,并整理得
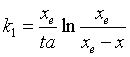 (40)
(40)
将式(40)代入式(38),可求k-1 ,或从已知平衡常数的式(37)求之。
另外,从式(37)得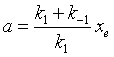 ,代入式(40)并整理之得
,代入式(40)并整理之得
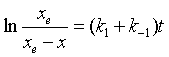 (41)
(41)
该式为1-1级对峙反应趋向平衡过程的动力学方程。形式上与单向的一级反应很相似,不同的是1-1级对峙反应在时间趋于无穷时,反应物A的浓度为( a-xe),而单向一级反应A的浓度却趋于零 ,如图8。
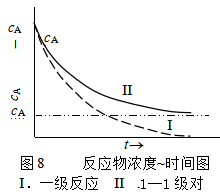
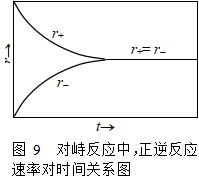
像这样趋向平衡的过程一般称为弛豫过程,从式(41)知,1-1级对峙反应的弛豫速率系数为 k = k1 +k-1 。在对峙反应中,正反应速率和逆反应速率对时间关系曲线如图9。
二、平行反应
当反应物同时进行两个或两个以上不同的反应时,称为平行反应。这类反应在有机化学中很常见,如甲苯硝化反应,可同时产生邻、对、间位的硝基甲苯。平行反应可区别为具有相同级数和不同级数的平行反应,为便于讨论,这里只介绍由两个一级反应组成的平行反应
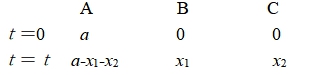
两个反应的速率方程分别为
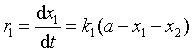
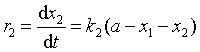
由于两个反应同时进行,据反应独立共存原理,反应总速率等于两个反应速率之和,即![]() 。若令 x1 + x2 = x ;用产物总生成速率表示时,则
。若令 x1 + x2 = x ;用产物总生成速率表示时,则
![]()
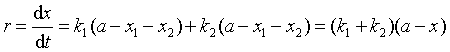
移项积分
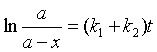 (42)
(42)
若将两平行反应的速率相除,可得 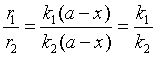
由于两个平行的反应具有相同级数,同时开始并独立进行,开始时并无产物存在,故其速率比等于各产物生成量之比。
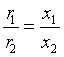
与上式比较,得
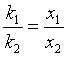 (43)
(43)
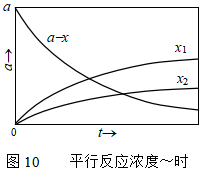
式(43)说明,在反应进行过程中,产物浓度比不变,始终等于两个反应的速率常数之比。在一定温度下,产物浓度比等于常数,这是相同级数平行反应的主要特点。平行反应中各浓度-时间曲线如图10所示。
将式(42)和式(43)联立求解,便可求得k1 和k2。从产物总生成速率表示式看出,具有相同级数的平行反应,其总速率系数k等于每个平行反应的 ki之和,![]() 。显然,总反应速率取决于平行反应中最快一步(ki 最大)的速率。若k1 和k2值相差很大时,速率大的为主反应,其余的为副反应。工业上,为了多获得某一产品,通常采用选择适当催化剂、改变温度等方法,改变 k1 / k2的值从而达到目的。
。显然,总反应速率取决于平行反应中最快一步(ki 最大)的速率。若k1 和k2值相差很大时,速率大的为主反应,其余的为副反应。工业上,为了多获得某一产品,通常采用选择适当催化剂、改变温度等方法,改变 k1 / k2的值从而达到目的。
对具有相同级数的二级平行反应,如氯苯的再氯化生成两种产物(邻二氯苯、间二氯苯)等,讨论方法类似。
三、连串反应
若一个复杂反应中,前一个基元反应的产物为后一个基元反应的反应物,这样的反应称为连串反应(consecutive reaction),或称连续反应。例如苯的液相氯化,生成的氯苯能进一步与氯作用生成二氯苯、三氯苯等。为方便讨论,以由两个单向连续的一级反应为例
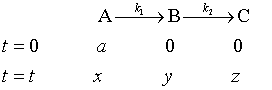
设反应开始时,系统只有A,经时间t后,A、B、C、的浓度分别为x 、y 、z 。
对于物质A, 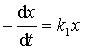
移项积分 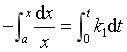
积分结果
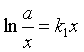 或
或 ![]() (44)
(44)
对于物质B,它的净反应速率应等于其生成速率与消耗速率之差
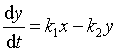 (45)
(45)
将式(44)中x 值代入上式,
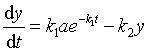
这是一个 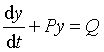 型的一次线性微分方程,方程的解为
型的一次线性微分方程,方程的解为
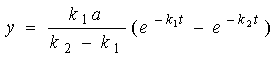 (46)
(46)
按化学计量方程式,![]() ,故
,故 ![]() 。 代入 x 及 y值并整理得
。 代入 x 及 y值并整理得
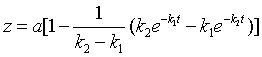 (47)
(47)
式(44)、式(46)、式(47)中x、y、z 值与时间的关系如图11。从图可知,A的浓度随时间降低很快趋于零,C的浓度随时间增加而上升,而中间产物B的浓度随时间的变化是开始升高,随后降低,存在着极大值,这是连串反应的特点。
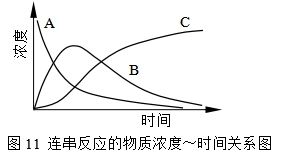
在极大值处,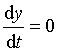 ,相应的反应时间为
,相应的反应时间为 ![]() ;代入式(7.46),解得
;代入式(7.46),解得![]() 为
为
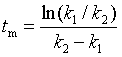 (48)
(48)
将式(48)代入式(46),可知B处于极大值的浓度![]() 为:
为:
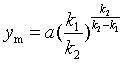 (49)
(49)
在化工生产中,如果需要的是中间产物B,根据连串反应的特点,可以将反应时间控制在![]() 附近来得到高浓度的中间产物。
附近来得到高浓度的中间产物。
当组成连串反应各基元反应速率相差很大时,则总的反应速率将由其中速率最慢的步骤决定,该步骤称速率控制步骤,简称“速控步骤”。如第一步为速控步骤,即![]() <<
<<![]() 时,则
时,则![]() >>
>> ![]() ,对式(47)可化简为
,对式(47)可化简为 ![]() ,z 的生成速率仅取决于最慢的速率系数k1;同理,若第二步是速控步骤,即
,z 的生成速率仅取决于最慢的速率系数k1;同理,若第二步是速控步骤,即![]() >>
>>![]() ,也可导出
,也可导出 ![]() ,z 的生成速率同样决定于最慢的速率系数k2 。只有加快控速步骤,才能提高总反应的速率。有时,可以将速控步的速率近似看作是整个反应的速率。
,z 的生成速率同样决定于最慢的速率系数k2 。只有加快控速步骤,才能提高总反应的速率。有时,可以将速控步的速率近似看作是整个反应的速率。
