第六章 化学动力学基础
 知识点六:链反应
知识点六:链反应
有一种具有特殊规律的复合反应,只要用光、热、辐射或其它方法引发,反应就能通过活性组分(自由基或自由原子)的生成和消失发生一系列的连续反应,就象链条一样自动进行下去,这类反应称为链反应。许多重要的化工过程,如石油的裂解、碳氢化合物的氧化、卤化以及橡胶、塑料、高分子化合物的制备等都与链反应有关。
链反应一般分为三个阶段,以下以HCl的气相合成反应为例来说明
H2 + Cl2 → 2HCl
(1)链的引发
Cl2+ M → Cl· + Cl· + M
反应物分子借助热、光、辐射等能量,或与载能的第三物种M碰撞而获取能量产生自由基等活性粒子的过程。“Cl· ”表示氯自由基,黑点代表自由原子Cl具有一个未配对电子。自由基具有的高活性决定了它不能长期稳定存在,将很快参加下一步的反应。在链的引发过程中,需要断裂分子中的化学键,此时所需要的活化能与断裂化学键所需要的能量是同一数量级。
(2)链的传递
Cl·+ H2 → HCl + H·
H· + Cl2 → HCl + Cl·
……
自由基等活性粒子很活泼,它们与饱和的反应物分子作用,在生成产物的同时,又产生新的自由基等活性粒子,这样不断交替使反应一环接一环的连续进行下去。如果反应不受阻碍,可以直至反应物耗尽。由于自由原子或自由基的能量较高,该阶段反应所需的活化能一般小于40kJ·mol-1。
(3)链的终止
Cl·+ Cl·+ M → Cl2+M (M为器壁或惰性粒子)
当自由基等活性粒子相互复合或歧化形成稳定分子,或与器皿及第三物种(M)碰撞而失去活性,将使链反应终止。链反应速率与器皿的形状或加入的惰性粒子都有关系,这种器皿效应是链反应的特征之一。
自由原子、自由基都有未配对电子,它们都具有很高的能量,所以它们与器壁或能量低的第三体相撞,将高的能量传出就会自相结合变成稳定分子。因此,当增加壁面与容积之比,或加入固体粉末时,若反应速率显著变慢或停止,则可推测反应可能是链反应;另外某些含有未配对电子的化合物,很容易与自由原子、自由基反应而中断一个反应链,因此若加入微量未配对电子的化合物(如NO),能对反应产生很显著的阻滞作用,也可以判断该反应可能是链反应。
根据链的传递方式的不同,可以将链反应分为直链反应和支链反应
1.直链反应
直链反应的链传递过程中,每消耗一个自由基(或原子),只产生一个新的自由基(或原子),即直链反应中自由基的数目(或称反应链数)不变。现以HCl的气相合成反应 H2+Cl2 → 2HCl为例,介绍直链反应速率方程的建立方法。
设反应历程如下
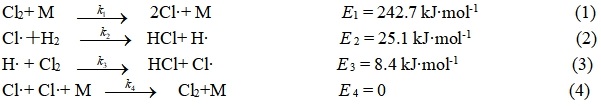
由于只有(2)(3)有HCl生成,故HCl生成速率为
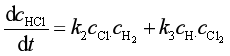 (106)
(106)
对于反应中产生的活性粒子Cl·和H·,可采用稳态近似处理法,即假设反应一开始它们立即达到了稳定状态,浓度不再随时间而改变
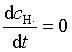 ,
,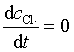 (107)
(107)
Cl·在反应(1)、(3)生成,在反应(2)、(4)中消耗
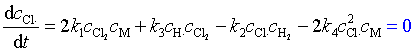 (108)
(108)
H·在反应(2)中生成,在反应(3)中消耗
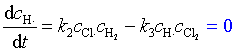 (109)
(109)
由上式可得
![]() (110)
(110)
将式(110)中代入式(108)得
![]()
移项得
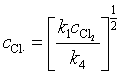 (111)
(111)
将式(110)及式(111)代入式(106)式,并整理得HCl生成速率
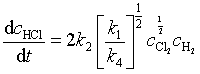
反应速率为 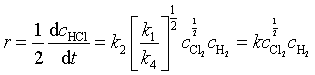 (112)
(112)
其中,k为表观速率系数 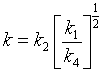 (113)
(113)
反应的总级数为1.5 级,对氢为1级,对氯为0.5级,导出的速率方程(112)与实验事实相一致。通过式(113)可以计算反应的表观活化能![]() , 根据
, 根据
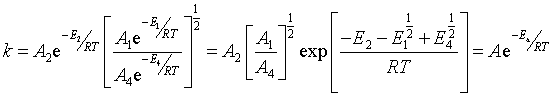
在表观活化能![]() 中,引发反应的活化能
中,引发反应的活化能![]() 最大,因为它是最难发生的反应,但总的表观活化能比
最大,因为它是最难发生的反应,但总的表观活化能比![]() 小。
小。
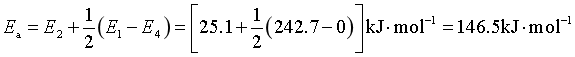
此外,如形成高分子化合物的聚合反应大部分是直链反应,其反应方程可表示为
链引发 M —→ M·
链传递 M·—→ MM·—→ MMM·—→……Mn·
链终止 Mn·—→ Mn
其聚合过程中,可以通过控制引发剂的用量或光照时间,来控制高分子的相对分子质量,从而得到不同性能的聚合产物。
2.支链反应
支链反应的链传递过程中,一个自由基(或原子)消失的同时,产生两个或两个以上新自由基,即自由基(或称反应链数)不断增加,如图7.21所示。从图中可以看出,支链反应中产生的新的自由基(或原子)又可以参加直链或支链反应,使反应速率迅速增加,甚至达到爆炸的程度,这种爆炸称“支链爆炸”。另外有一种爆炸是当一个放热反应在无法散热的情况下进行,系统的温度急剧上升,而升温的结果又使反应速率按指数规律增加,并放出更多的热,使反应速率几乎无休止的增加,最终导致发生爆炸。这种爆炸称为“热爆炸”。
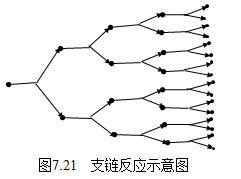
下面以H2和O2的化合反应为例来了解支链反应的特点。H2和O2的反应机理至今尚未完全确定,一般认为由以下一些基元反应组成


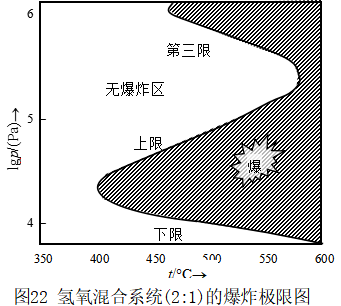
支链反应虽能导致爆炸,但并不是所有的支链反应在任何情况下都会爆炸,只要将条件控制好,支链反应也可以平稳地进行。图22是氢氧混合系统(比例为2:1)的爆炸界限与温度、压力的关系。从图中可看出,在673K以下,反应速率缓慢;在853K以上,任何压力都发生爆炸,在673~853K范围内,有一个爆炸区,区内每一温度下均有二个压力界限值,称第一爆炸界限和第二爆炸界限(对H2和O2体系,还存在第三爆炸界限)。 当压力在第一界限以下时,反应速率缓慢而不会爆炸,原因是气体较稀少,活性粒子在四壁上销毁占优势,链销毁速率大于链传递速率,故不爆炸。压力继续增加时,链传递速率急剧增加,导致爆炸,进入爆炸区。但压力增大至第二爆炸界限时,气体浓度相当大,分子间碰撞频繁,气体中有相当一部分惰性分子存在,使得链销毁的速率又大于链传递的速率,系统进入无爆炸区。H2、O2系统在第三界限以上的爆炸属于热爆炸。
对于支链反应,可利用爆炸界限的原理,控制反应条件,使反应以稳定的速率进行。实验还证明,氢氧混合气体,当氢的体积分数在4%~94%之间会爆炸,而小于4或大于94%(爆炸高限)就不会爆炸。表7.4中列的是某些可燃气体在空气中的爆炸界限。
表7.4 常温常压下的可燃气体在空气中的爆炸界限
可燃气体 |
爆炸界限体积分数 |
可燃气体 |
爆炸界限体积分数 |
||
低限 |
高限 |
低限 |
高限 |
||
H2 |
4 |
74 |
C2H2 |
2.5 |
80 |
NH3 |
16 |
27 |
C6H6 |
1.4 |
6.7 |
CS2 |
1.25 |
44 |
CH3OH |
7.3 |
36 |
CO |
12.5 |
74 |
C2H5OH |
4.3 |
19 |
CH4 |
5.3 |
14 |
(C2H5)2O |
1.9 |
48 |
C2H4 |
3.0 |
29 |
CH3COOC25H5 |
2.1 |
8.5 |
C2H6 |
3.2 |
12.5 |
|
|
|
了解了爆炸原理和规律,可以达到防爆目的,如防止热爆炸就需要采取良好散热措施或控制原料量,使反应温度不至于升得太高。又如为防止支链爆炸,在对气体反应器加料时,要控制在爆炸低限;检修含有可爆炸性气体的设备时,先用蒸气或氮气充分吹风,室内煤气泄漏时,也要使之通风,使设备内、室内的气体组成低于爆炸界限,以确保安全。
上面介绍的热爆炸和支链爆炸均属于“化学爆炸”,特别要指出的是,原子弹的爆炸反应也是支链反应,与前面介绍的一个活性粒子活化后产生多个活性粒子不同的是,原子弹爆炸的支链反应中是由 ![]() 核裂变放出中子(一般2~3个),这些中子又引起邻近的
核裂变放出中子(一般2~3个),这些中子又引起邻近的![]() 核发生裂变,从而放出更多中子,致使更多
核发生裂变,从而放出更多中子,致使更多![]() 核裂变……形成支链核反应。连续裂变释放的能量不断积聚,使爆炸威力增加,这类爆炸称为“核爆炸”。
核裂变……形成支链核反应。连续裂变释放的能量不断积聚,使爆炸威力增加,这类爆炸称为“核爆炸”。![]() 核的裂变反应有多种,其中之一是
核的裂变反应有多种,其中之一是
![]()
将支链核反应放在原子反应堆中,控制反应进行条件,可以使具有破坏性的支链核爆炸变为非爆炸性的可控核链锁反应,例如原子反应堆中核燃料采用低富铀、用重水或石墨作中子减速剂,并通过中子吸收棒随时对中子数目进行控制,可使核支链反应服务于核电建设以及其它领域,造福于人类。
