第六章 化学动力学基础
 知识点七:反应机理的推测
知识点七:反应机理的推测
一、反应机理推测的方法介绍
动力学的主要任务之一是确定反应机理,所谓反应机理,即指反应物转变为产物的真实历程。确定机理一般要做以下工作:
1.参考前人相关的研究成果,根据有关的物质结构知识及从实验得到的总速率方程,对反应提出可能的机理假设。在做出假设时,要考虑以下几个因素:
(1) 速率因素,从所假设的机理求出的速率方程式应与实验结果相一致。
(2) 能量因素,从所假设的机理求出的表观活化能应与实验活化能一致。
(3) 结构因素,所假设反应机理的中间物或过渡态应与结构化学规律(如分子轨道对称性守恒原理)相符合。
2.利用质量作用定律,写出各基元反应的速率方程式并通过严格的或近似的数学运算(例如平衡假设、稳态近似处理等),将在速率方程式中出现的不稳定中间产物的浓度消去,求得只包含有稳定物质组分(一般应是反应物)的反应动力学方程,再与实验结果相对照,作出判断和选择。
3.继续设计新的实验来进一步确证反应机理的真实性,其中包括对中间物的定性或定量的鉴定等,必要时可进行量子化学的计算,从理论上来论证所提出的机理是正确的。
此外,前人在由反应速率方程推测反应机理方面,还总结了若干经验规则,也有助于用以确定正确的反应机理。
例8 对 CO+Cl2 → COCl2 的反应动力学实验,证明其速率方程式为
![]()
根据前人总结的若干经验规则之一表明:如出现分数的反应级数,常表明在速控步骤前存在着离解平衡的反应,因此可设想机理如下
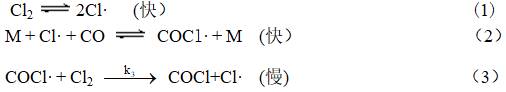
基元反应(3)是慢步骤,即速控步骤,它前面存在两个快速可逆反应(1),(2),假设它们会在速控步骤之前较快达到平衡,则可以由平衡常数求得中间产物的浓度,进而建立总反应的速率方程。该方法称为平衡态假设法或平衡态近似法。据此可得
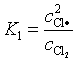
![]() (62)
(62)
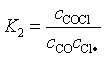
![]() (63)
(63)
因(3)为速控步骤,总反应速率取决于该反应的速率,即
![]()
将式(63)代入得
![]() (64)
(64)
所得结果与实验得出的速率方程一致,故设想的反应机理可接受。当然,还可从各基元反应的活化能来估计总的活化能(如例11),然后与实验的表观活化能对照,或设法证实中间物的存在等来进一步证明机理的合理性。
以上介绍的平衡态假设法,之所以称为“假设”,是因为在进行化学反应的系统中,完全平衡是达不到的,这仅是一种近似的处理方法。另外,从上例可以看出,如果含有可逆反应的连续反应中,若存在着速控步骤,则总反应速率系数仅取决于速控步骤及之前的平衡过程。若速控步后面还有快反应,此快反应与总速率系数无关。
例9 N2O5的热分解反应 N2O5 → N2O4 + ![]() O2
O2
实验求出此反应的速率方程式为 ![]() 显示为一级反应,欧格(Ogg)认为这是一个复杂反应,并假定其反应机理为
显示为一级反应,欧格(Ogg)认为这是一个复杂反应,并假定其反应机理为
N2O5 ![]() NO2+NO3
NO2+NO3 ![]()
NO2+NO3 ![]() NO+O2+NO2
NO+O2+NO2
NO+NO3 ![]() 2NO2
2NO2
若以N2O5的分解速率表示反应速率,则
![]() (65)
(65)
对基元反应中出现的中间产物 NO 和 NO3 可采用另一种数学处理方法,即稳态近似处理法,该法假设反应速率达到稳定态后,活泼中间产物的浓度不再随时间而变化,即
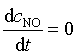 ,
, 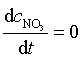
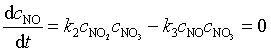
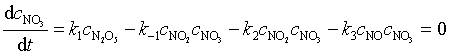
以上二式相减得 ![]()
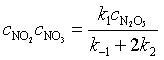
代入式(65)得
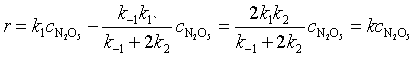 (7.66)
(7.66)
得到的速率方程表达式与实验一致,表明拟定的反应机理可能是合理的。
以上两例,分别是平衡态假设法和稳态近似处理法,究竟使用哪一种方法处理,要视实际情况而定。
对总反应为 A + B ![]() P ,其中一种历程为
P ,其中一种历程为
(1) A == C
(2) C + B![]() P
P
若C为活泼中间产物时,可以对中间产物C作稳态近似处理
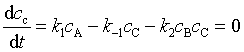
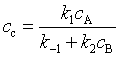
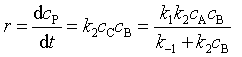 (67)
(67)
讨论:1. 当k2 CB >>k-1 即(2)是快步骤时,代入式(67)后,即整个反应速率表示为
![]() (68)
(68)
(1)是反应的速控步骤,反应物B出现在速控步骤(1)之后,并不影响反应速率。
2. 当 k-1>>k2CB,即(2)是速控步骤时,代入式(67)后,即整个反应速率表示为
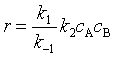 (69)
(69)
若换一个角度来考虑,如k-1 >>k1 时能使(1)的平衡很快建立,这时可以用平衡假设 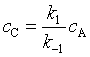
代入式(67)得 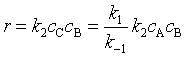 ,该式即为(69)式。
,该式即为(69)式。
可见平衡假设是稳态处理中的一种特定情况,两种方法没有严格规定的界限。
在推测反应机理过程中,反应级数的实验数据是检验所拟定机理的重要依据,但光靠速率因素的论据还不能证明一个反应机理的充分正确,还要从能量和结构因素等方面进行更多的理论和实验研究才行,目前,分子束实验技术和分子反应动态学的发展,对反应机理的拟定起重要作用。另外,还要注意到,有些反应,在不同的条件下可能会有不同的反应机理。
如乙醛热分解反应 CH3CHO![]() CH4+CO
CH4+CO
实验证明,在不同的实验条件下,该反应有不同的总速率方程:
![]() 和
和 ![]()
进一步的研究分析说明,两种情况下,组成总反应的基元反应步骤是有差别的。
二、反应机理推测的实例分析
例10 丙酮溴化反应 CH3COCH3 +Br2 ![]() CH3COCH2Br+HBr
CH3COCH2Br+HBr
实验证实其反应速率为
![]() (70)
(70)
速率方程式中出现 H+ ,而计量方程中 H+ 并未参与反应,可见 H+ 应为催化剂,根据前人总结的规则,如果催化剂级数为正值,它是做正向反应的催化剂,它或为速控前平衡反应的反应物,或参加速控步骤而在随后的快速反应中再生。Br2在计量方程中出现而在速率方程中级数为零,可见它对反应速率无影响,故应在速控步骤之后参加反应。根据其它反应证实,丙酮的烯醇化是速控步骤,因此可以推测丙酮溴化的历程为
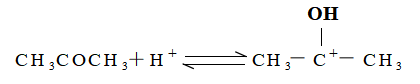 (快速平衡)
(快速平衡)
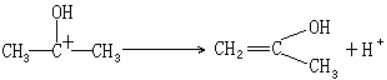 (速控步骤)
(速控步骤)
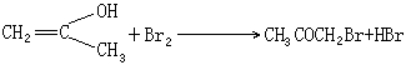 (快速步骤)
(快速步骤)
用平衡假设处理可得与实验结果一致的速率方程,以上历程与均相酸碱催化的普遍反应历程也是一致的。
例11 H2 + I2 ![]() 2HI 反应多少年来,人们都曾将此反应说成是简单反应,而且还提出了四元环的反应历程
2HI 反应多少年来,人们都曾将此反应说成是简单反应,而且还提出了四元环的反应历程
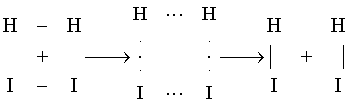
并根据简单双分子反应直接用质量作用定律表示反应速率
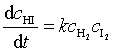
尽管从四元环的反应历程导出的速率方程与实验所得到的速率方程相一致,但是还是受到质疑。早在1967年苏里文根据量子力学原理指出,四元环的双分子反应机理是一个在量子力学上的对称禁阻反应,不可能进行。同时他的一系列实验也否定了上述历程,他在420K ~ 520K 温度范围内用波长 578nm 光照 H2 和 I2 系统,发现能加速反应,而且这一光辐射能量只能使 I2 分子裂解,不能使 H2 分子裂解,表明反应历程一定涉及到 I· 。接着,苏里文用光化学方法直接测定 2I·+ H2 ![]() 2 HI 反应速率系数k2与温度的关系,并作
2 HI 反应速率系数k2与温度的关系,并作 ![]() ~
~![]() 图;同时根据热化学,计算不同温度时的k2值,同样作
图;同时根据热化学,计算不同温度时的k2值,同样作![]() ~
~![]() 图,结果两者在同一直线上。从直线斜率求得活化能,也证实 2I·+ H2
图,结果两者在同一直线上。从直线斜率求得活化能,也证实 2I·+ H2 ![]() 2 HI 反应的存在。因此,反应机理应该为
2 HI 反应的存在。因此,反应机理应该为
I2 + M ![]() 2I·+ M (快)
2I·+ M (快)
2I·+ H2 ![]() 2 HI (慢)
2 HI (慢)
2I·+ M ![]() I2 + M (快)
I2 + M (快)
以上简单讨论,说明具有简单级数的反应,并不一定是简单反应,宏观动力学规律性对于验证反应机理是必要的,但还是不充分的。反应机理的可靠性,还要依赖于大量的其它实验或理论来证实。
