知识点二:离子的迁移数
一、电解质溶液的导电机理
离子在电场作用下的定向移动称为离子的电迁移。考察如下一个电解池::
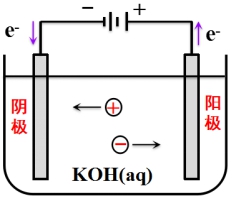
(1)电解池分为三个部分。
(2)含有15 mol的KOH溶液。
(3)通过溶液的电量为4F。
(4)负离子迁移速率是正离子的3倍:r-= 3r+
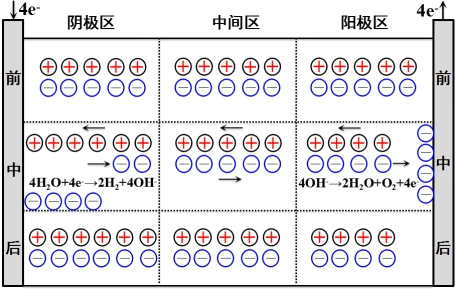
电解过程的总结果是:
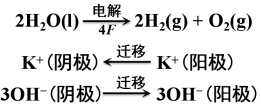
结论:
(1)电解质溶液的导电是由正、负离子共同承担的。
(2)正离子迁移的电量与负离子迁移的电量之和等于通过溶液的总电量。即:Q+ + Q-= Q
(3)由于正、负离子的迁移速率(以及所带电荷)不同,所以正、负离子所迁移的电量不一定相等。即:Q+≠Q-
【练习题】在其它条件不变的情况下,若 ![]() ,试讨论上述变化情况。
,试讨论上述变化情况。
二、离子的电迁移率

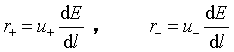
电迁移率![]() 的单位为:
的单位为:![]() 。它包含了除电位梯度以外的影响离子迁移速率的因素。
。它包含了除电位梯度以外的影响离子迁移速率的因素。
298 K时无限稀释水溶液中的离子的电迁移率
|
|
||
|
|
|
|
【思考题】(1)为什么同族元素中离子半径越小,其电迁移率也越小?即:
![]() Li+)<
Li+)<![]()
![]() <
<![]()
![]() 。
。
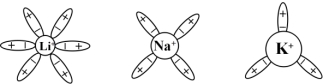
离子半径小,周围电场强度大,吸引极性水分子数多,电迁移速率慢。
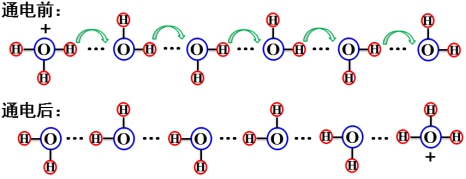
(2)![]()
![]() 和
和![]()
![]() 特殊大的原因:链式的氢键重排。
特殊大的原因:链式的氢键重排。
接下来让我们进行下一部分的学习
