知识点三:电解质溶液的电导
三、电导率、摩尔电导率与浓度的关系
电解质溶液的电导率、摩尔电导率均与浓度有关,但强、弱电解质所表现出的规律不尽相同。
电导率:![]()
摩尔电导率:![]()
![]()
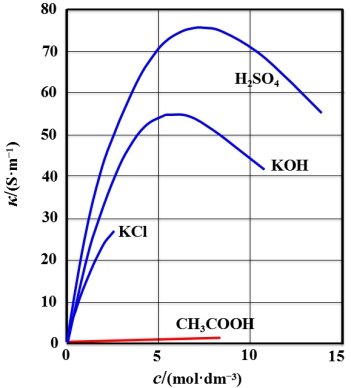
【思考题】从上图中你可以发现哪些规律,利用上面公式给予解释。
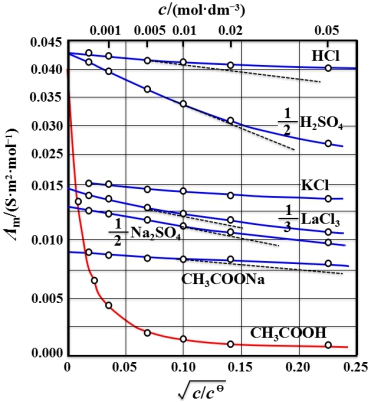
【思考题】试利用上面公式解释 ![]() 随浓度的变化规律。
随浓度的变化规律。
科尔劳施(kohlrausch)关系式:
![]()
![]()
![]()
式中![]() 称为根限摩尔电导率。该式适用于强电解质的稀溶液。
称为根限摩尔电导率。该式适用于强电解质的稀溶液。
利用该式可外推求强电解质的![]() 。
。
四、离子独立移动定律和离子的摩尔电导率
在无限稀释时,所有电解质都全部电离,且离子间的相互作用可以忽略,离子在电场作用下的移动速率与其共存离子的性质无关。
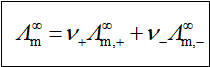
此式称为离子独立移动定律。
应用:计算弱电解质的![]()
![]()
![]()
![]()
【思考题】强电解质和弱电解质的 ![]() 各有几种求法。
各有几种求法。
五、电导测定的应用
1、测定弱电解质的![]()
对于弱电解质,由于电离度较小,溶液中离子的浓度不大,可以认为:
![]() ,
, ![]()
![]()
![]()
![]()
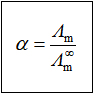
![]() 对于价型为
对于价型为![]() 的弱电解质,其电离平衡为
的弱电解质,其电离平衡为
![]()
![]()
![]()
平衡时 ![]()
![]()
![]()
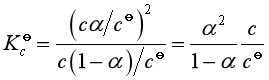
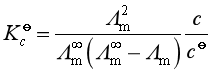
此式称为奥斯特瓦尔德稀释定律。
2、测定难溶盐的溶解度
![]()
![]()
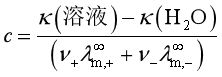
3、电导滴定
利用滴定过程中溶液电导的转折变化来确定滴定终点,称为电导滴定。
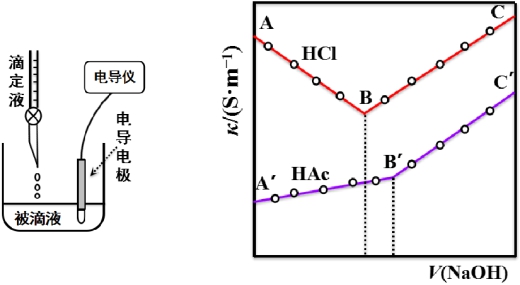
强碱滴定强酸:![]()
强碱滴定弱酸:![]()
接下来让我们进行下一部分的学习
