演示实验:离子的电迁移
一、实验目的
演示在电场作用下离子的定向移动及不同的迁移速率
二、演示方法
在U形管中进行离子的电迁移实验
1.取2g琼胶溶于100 mL水中,加热并加入饱和KCl溶液30 mL,加几滴酚酞,再加几滴NaOH使溶液呈红色,分两次加到高为15~20 cm的U形管中A部(如图所示)并冷凝。
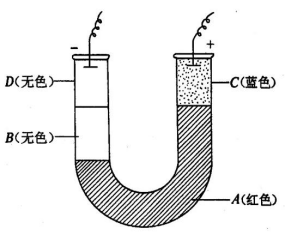
2.向余下的溶液中加入HCl溶液中和其中的碱,并过量几滴,使溶液呈酸性加入到U形管左边的B处,并冷凝。
3.再将6 mLCuCl2的饱和溶液加入20mLH2O中,并滴加数滴HCl溶液,将此蓝色溶液放到U形管右边的C处。
4.在20 mL饱和KCl溶液中加入10%NaOH溶液2mL,放到U形管左边的D处。
5.U型管两端各插入电极,加32V直流电压(电压高些更好,可使离子迁移快些,但要防止冷凝的琼胶被破坏)。通电20~30分钟即可观察到U型管中右边A红色的界面消失变成无色层,并逐渐向下移动;蓝色C的界面也向下移动。且红色层消失总在蓝色层之前。说明Cu2+及H+向阴极移动,且H+迁移速率大于Cu2+的迁移速率。左边OH-移动使无色B变成红色。
三、思考题:试讨论上述实验中离子的电迁移情况。
本实验也可以在玻璃板上进行:
1.取长方形玻璃片一块,取两张滤纸分别浸入含有甲基橙及酚酞的![]() 氯化钠溶液中浸湿。把浸湿的滤纸贴在玻璃上,滤纸间用铜片串联起来。两边的滤纸以弹簧夹夹住。
氯化钠溶液中浸湿。把浸湿的滤纸贴在玻璃上,滤纸间用铜片串联起来。两边的滤纸以弹簧夹夹住。
2.将浸有![]() 的HCl溶液的脱脂棉纱线放到浸有甲基橙的滤纸中间,将浸有
的HCl溶液的脱脂棉纱线放到浸有甲基橙的滤纸中间,将浸有![]() 的NaOH溶液的棉纱线放在浸有酚酞的滤纸中间(如图所示)。
的NaOH溶液的棉纱线放在浸有酚酞的滤纸中间(如图所示)。

3.将32V直流电压加到滤纸两端,通电后很快看到滤纸中棉线两红色区域向不同方向的电极移动,H+向阴极,OH-向阳极。
实验设计:醋酸溶液导电性研究
醋酸是一种弱电解质,在水中部分电离,其电离度与溶液的浓度有关,随着浓度溶液的增加,电离度下降。因此溶液中H+与Ac-浓度随溶液浓度的变化受到两种相反因素的影响,其一是由于醋酸浓度增大导致H+和Ac-浓度增大;其二是由于醋酸电离度下降导致H+和Ac-浓度减小。上述两种因素对醋酸导电性的影响如何,需通过设计实验加以验证,反过来也可以通过研究醋酸溶液的导电性分析出H+和Ac-浓度的变化情况。
一、实验原理
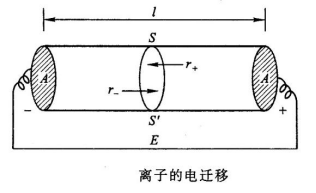
能导电的物质称为导体。导体主要有两类:一类是电子导体,如金属、石墨等,它们是靠自由电子在电场作用下的定向移动而导电。当电流通过这类导体时,除了可能产生热效应外,不发生任何化学变化。另一类是离子导体,如电解质溶液、熔融的电解质或固体电解质等,这类导体依靠离子在电场作用下的定向迁移而导电,其导电能力随温度的升高而增强。
设在浓度为c的电解质![]() 的溶液中,放入两个面积均为A的金属电极,两电极间的距离为
的溶液中,放入两个面积均为A的金属电极,两电极间的距离为![]() ,电势差为E,电流强度为
,电势差为E,电流强度为![]() 。则溶液的电导率为
。则溶液的电导率为
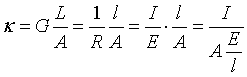
设电解质![]() 的电离度为
的电离度为![]() ,在溶液中按下式电离:
,在溶液中按下式电离:
![]()
平衡时
![]()
![]()
![]()
![]()
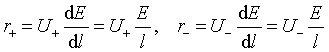
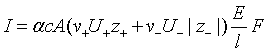
代入电导率![]() 的表达式,得
的表达式,得
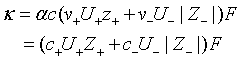
即电解质的电导率是由正、负离子对电导率的贡献之和。
二、仪器与试剂
电导电极;DDS-11A型电导率仪;100 ml烧杯一个;浓度为![]() 的醋酸溶液100 ml。
的醋酸溶液100 ml。
注:如果没有上述电导率仪和电导电极,可以采用两根铜棒代替电导电极,以四节干电池(1.5V)代替直流电源,以毫安表的读数或根据小灯泡的亮度来指示导电能力,进行简易的实验。
三、实验操作
1.用![]() 的醋酸溶液,采取逐步稀释的方法,分别配制成8.0、7.0、6.0、5.0、4.0、3.0、2.0、1.0
的醋酸溶液,采取逐步稀释的方法,分别配制成8.0、7.0、6.0、5.0、4.0、3.0、2.0、1.0![]() 的醋酸溶液,然后逐个用电率仪测定其电导率。
的醋酸溶液,然后逐个用电率仪测定其电导率。
2.将上述测量的电导率记录于下表中
c/ |
1.0 |
2.0 |
3.0 |
4.0 |
5.0 |
6.0 |
7.0 |
8.0 |
|
|
|
|
|
|
|
|
|
同学们可以根据此表数据描绘出电导率随浓度变化的曲线。
四、数据分析
试解释电导率随浓度变化的曲线。

