第七章 电解质溶液
 知识点一:基本概念和电解定律
知识点一:基本概念和电解定律
一、原电池和电解池
能导电的物质称为导体。导体分为两类:第一类导体是电子导体,如金属、石墨等,它们是靠自由电子在电场作用下的定向移动而导电。当电流通过这类导体时,除了可能产生热效应外,不发生任何化学变化。一般地,该类导体的导电能力随温度的升高而降低,因为温度升高时,这类导体的内部晶格质点的热运动加剧,自由电子的定向运动的阻碍增加,因而电阻增大,导电能力下降。第二类导体是离子导体,如电解质溶液、熔融的电解质或固体电解质等,这类导体依靠离子在电场作用下的定向迁移而导电。由于温度升高时,溶液的粘度降低、离子运动速度加快、在水溶液中离子水化作用减弱等因素的综合作用,加快了离子的定向运动速度,因而这类导体的导电能力随温度升高而增强。离子导体导电时,在电化学装置的两个电极表面上必然伴随有电化学反应的发生,从而实现化学能与电能间的相互转化。
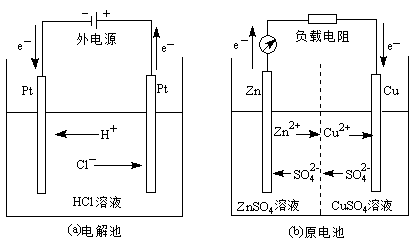
![]()
我们利用图1中的实例来说明电解质溶液的导电机理以及化学能与电能是如何相互转化的。
图1(a)为一电解池,它由与外电源相连接的两个金属铂电极插入HCl水溶液而构成。当发生电解时,在溶液中,由于电场力的作用,带正电荷的H+向着与外电源负极相连的、电势较低的铂电极迁移,带负电荷的Cl-向着与外电源正极相连的、电势较高的铂电极迁移。电化学中,将离子在电场作用下而引起的定向运动称为离子的电迁移。正是这些带电离子的电迁移,形成了溶液中的电流。
那么,在两个电极的金属/溶液界面处,电流是如何得以连续通过的呢?
我们知道,电子(e-)一般是不能自由进入溶液的,因此,为使电流能在整个回路通过,必须在每个电极的金属/溶液界面处发生有电子参与的化学反应,这就是电极反应。由于电极反应是有电子参与的化学反应,这就必然引起一些化学物种氧化状态的改变。与外电源正极相连的金属电极的金属/溶液界面处只有发生物种的失电子反应,才能补充电流通过整个回路时在该电极上流失的电子,因此,该电极上发生氧化反应;与外电源负极相连的金属电极的金属/溶液界面处只有发生物种的得电子反应,才能取走电流通过整个回路时流入该电极的电子,因此,该电极上发生还原反应。
这样,只要外加电压达到足够数值,图1(a)的电解池装置中,负极附近的H+就会与负极上的电子结合,发生还原作用而放出氢气:![]() ;正极附近的Cl-向正极释放电子,发生氧化作用而放出氯气:
;正极附近的Cl-向正极释放电子,发生氧化作用而放出氯气:
![]() 。两电极上的氧化还原作用结果使负极有电子“进入”了溶液,而正极得到了从溶液中“跑出来”的电子,电流在两个金属/溶液界面处得以连续通过。
。两电极上的氧化还原作用结果使负极有电子“进入”了溶液,而正极得到了从溶液中“跑出来”的电子,电流在两个金属/溶液界面处得以连续通过。
该电解池的总结果是:外电源消耗了电功而迫使电解池内发生了电解反应![]() ,这是一个非自发反应。
,这是一个非自发反应。
电化学装置中电极的命名通常有两种方法。一种是根据电极上发生的化学作用的类型不同,将电极分为阳极和阴极,并规定:发生氧化反应的电极为阳极;发生还原反应的电极为阴极。另一种是根据电极电势的高低,将电极分为正极和负极,电势高的为正极,电势低的为负极。因此,电化学装置中的一个电极可以有不同的名称。例如,在电解池中,与外电源正极相连的电极,其电极电势较高,是正极,同时在该电极上发生氧化反应,故该电极也是阳极;与外电源负极相连的电极,其电极电势较低,同时在该电极上发生还原反应,故该电极是负极也是阴极。习惯上,对电解池常用阳极和阴极命名,而对原电池则常用正极和负极命名。
图1(b)为一原电池,它由一定浓度的、插有金属Zn的ZnSO4溶液和一定浓度的、插有金属Cu的CuSO4溶液通过盐桥(图中用虚线表示)连接而成的电化学装置,此电池称为丹尼尔电池。在该电池放电时,Zn电极上发生氧化作用:![]() ,Zn2+进入溶液,电子留在Zn电极上,使该电极具有较低的电势,因此,Zn电极是阳极也是负极;Cu电极上发生还原作用:
,Zn2+进入溶液,电子留在Zn电极上,使该电极具有较低的电势,因此,Zn电极是阳极也是负极;Cu电极上发生还原作用:![]() ,Cu2+在金属/溶液界面处得电子后变成金属Cu沉积在Cu电极上,该电极由于失去电子而具有较高的电势,因此,Cu电极是阴极也是正极。在该电池放电时,电池内溶液中阳离子向阴极移动,阴离子向阳极移动,电流在溶液中的传导是由阴、阳离子的移动共同承担的。
,Cu2+在金属/溶液界面处得电子后变成金属Cu沉积在Cu电极上,该电极由于失去电子而具有较高的电势,因此,Cu电极是阴极也是正极。在该电池放电时,电池内溶液中阳离子向阴极移动,阴离子向阳极移动,电流在溶液中的传导是由阴、阳离子的移动共同承担的。
该原电池的总结果是:由于自发变化![]() 的进行,导致两电极间存在电势差,使电池能够对外作电功。
的进行,导致两电极间存在电势差,使电池能够对外作电功。
总之,当电化学装置中有电流通过时,电子导体中的电子和离子导体中的离子在电场的作用下都发生定向移动。在电解质溶液中阴离子总是向阳极(不一定是正极)移动,而阳离子总是向阴极(不一定是负极)移动;在两个电极/溶液的界面处电流的连续流过是通过分别发生氧化作用或还原作用导致电子得失而实现。可见,若要借助电化学装置实现化学能与电能间的持续转化,必须既有电解质溶液中的离子定向迁移,又有电极上发生的电极反应,两者缺一不可。
二、法拉第电解定律
1833年,法拉第从研究电解作用的实验中总结出了一条定律:当电流通过电解质溶液时,通过电极的电量与发生电极反应的物质的量成正比,此即法拉第电解定律。
电学中,将与电子所带电量大小相等,符号相反的质点称为元电荷,通常把质子当作元电荷,用符号e表示。摩尔元电荷所带的电量称为法拉第常量,用符号F表示,则
![]()
式中L为阿伏加德罗常量,e是元电荷的电量。在一般的计算中,可以近似取![]() 。
。
若欲从含有![]() 离子的溶液中沉积出1mol金属M,即需要通过
离子的溶液中沉积出1mol金属M,即需要通过![]() mol的电子,
mol的电子,
![]()
式中![]() 代表电子,
代表电子,![]() 为电极反应式中的电子计量数。因此,当通过的电量为Q时,可以沉积出的金属M的物质的量n为:
为电极反应式中的电子计量数。因此,当通过的电量为Q时,可以沉积出的金属M的物质的量n为: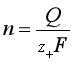 ,通常将该式写作
,通常将该式写作
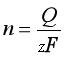 或
或 ![]() (1)
(1)
所沉积出的金属的质量为
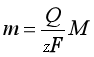 (2)
(2)
式中M为金属的摩尔质量。式(1)或(2)即为法拉第定律的数学表达式。
法拉第定律虽然是法拉第在研究电解作用时从实验结果归纳得出的,但实际上该定律无论是对电解池中的过程,还是对原电池中的过程都是适用的。它是自然界中最准确的定律之一。该定律不受电解质浓度、温度、压力、电极材料、溶剂的性质等因素的影响,没有使用的限制条件。实验愈精确,所得结果与法拉第定律符合愈好。
值得注意的是,实际电解时电极上常发生副反应,如实际镀锌时,在阴极上除了进行锌离子的还原反应外,还可能同时发生氢离子还原的副反应,因此要析出一定量的某一物质时,实际上所消耗的电量要比按照法拉第定律计算所需要的理论电量多一些,此两者之比为电流效率,通常以百分数表示:
 (8.3a)
(8.3a)
或者当通过一定电量后,
 (8.3b)
(8.3b)
例1 需在10×10cm2的薄铜片两面镀上0.005cm厚的Ni层,电镀液为Ni(NO3)2水溶液,假定镀层能均匀分布,用2.0A的电流强度得到上述厚度的镍层时需通电多长时间?设电流效率为96.0%,已知金属镍的密度为8.9g·cm-3,Ni的摩尔质量为58.69g·mol-1。
解 电镀层中含Ni的物质的量为
![]()
电极反应为:Ni2++2e-→Ni(s)
则 Q=nzF/0.96=(0.1516×2×96500/0.96) C=3.05×104C
t=Q/I=(3.05×104/2.0) s=15250 s = 4.24h
