第七章 电解质溶液
 知识点二:离子的电迁移和迁移数
知识点二:离子的电迁移和迁移数
一、离子的迁移数
如前所述,当电流通过电解质溶液时,在两电极上发生电极反应的同时,电解质溶液中相应地发生阴、阳离子的电迁移而共同完成导电任务。但是由于阴、阳离子运动速度的差别,使得电解质溶液中阴、阳离子迁移的电量并不一定相等。
离子在电场中的运动速度,除了与离子的本性(如离子所带电荷、离子半径、离子的水化程度等)、溶液的浓度、溶剂性质、温度等因素有关外,还与电场的电位梯度![]() 有关,其间的定量关系为:
有关,其间的定量关系为:
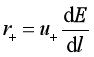 ,
, 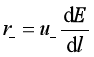 (4)
(4)
式中,r为离子在电场中的运动速度,比例系数u相当于单位电位梯度(![]() )时离子在一定溶液中运动的速度,称为离子的电迁移率,其单位为
)时离子在一定溶液中运动的速度,称为离子的电迁移率,其单位为![]() 。离子的电迁移率的大小与溶剂、温度、浓度等因素有关。表1为298.15K时无限稀释水溶液中几种离子的电迁移率。
。离子的电迁移率的大小与溶剂、温度、浓度等因素有关。表1为298.15K时无限稀释水溶液中几种离子的电迁移率。
表1 298.15K时一些离子在无限稀释水溶液中的电迁移率
阳离子 |
|
阴离子 |
|
|
36.30 |
|
20.52 |
|
7.62 |
|
8.27 |
|
6.59 |
|
7.91 |
|
5.19 |
|
7.40 |
|
4.01 |
|
4.61 |
某种离子B迁移的电量与该溶液中通过的总电量之比称为该溶液中离子B的迁移数,以符号tB表示。因此,
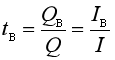 (5)
(5)
式中![]() ,可见tB为量纲一的量,且
,可见tB为量纲一的量,且![]() 。
。
设物质的量浓度为c的电解质![]() 在溶液中全部解离,任一离子B的浓度为νBc,若该离子所带的电荷为
在溶液中全部解离,任一离子B的浓度为νBc,若该离子所带的电荷为![]() ,则考虑电位梯度方向上面积为A的截面可知B离子传导的电量为
,则考虑电位梯度方向上面积为A的截面可知B离子传导的电量为
![]() (t为时间) (6)
(t为时间) (6)
则通过溶液的总电量为
![]() (7)
(7)
因此,
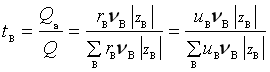 (8)
(8)
若溶液中只有一种阳离子和一种阴离子,则由于整个电解质溶液呈电中性而有关系式![]() ,因此可得
,因此可得
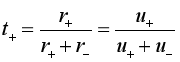 (9a)
(9a)
同样:
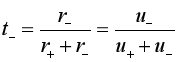 (9b)
(9b)
若溶液中阳离子和阴离子都不止一种,则任一离子B的迁移数tB均可用式(8)计算,且![]() 。
。
可见,凡是影响离子运动速度的因素就有可能影响离子的迁移数,例如当电解质溶液的浓度或温度发生变化时,都会使离子的迁移数发生改变,所以给出溶液中离子的迁移数时,应注明溶液的浓度和温度。不过,由于电场强度以相同比例改变阴、阳离子的运动速度,故离子的迁移数不受电场强度的影响。
二、界面移动法测定离子的迁移数
实验中,最常用的测量离子迁移数的方法有希托夫迁移法、界面移动法、电动势法等,其中后两种方法均可获得较精确的结果。电动势法将在下一章中讨论,下面介绍界面移动法。
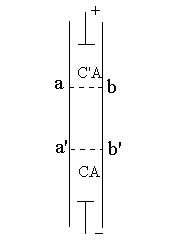
![]()
界面移动法直接测定溶液中离子的移动速度。若欲测定CA溶液中C+离子的迁移数,则可将此溶液置于一个垂直的细玻璃管中,然后由上部小心地加入![]() 溶液做指示溶液。两种溶液的密度不同,使这两种溶液间有一清晰的分界面ab (通常可借助于溶液的颜色或折射率的不同加以识别)(图2所示)。通电一定时间后,ab界面移至
溶液做指示溶液。两种溶液的密度不同,使这两种溶液间有一清晰的分界面ab (通常可借助于溶液的颜色或折射率的不同加以识别)(图2所示)。通电一定时间后,ab界面移至![]() 。选择适宜的条件,使
。选择适宜的条件,使![]() 离子的移动速度略小于C+离子的移动速度,这样,通电时
离子的移动速度略小于C+离子的移动速度,这样,通电时![]() 离子和C+离子顺序地向阴极移动,可以观察到清晰界面的缓慢移动。若通过的电量为Q,则C+离子迁移的电量为t+Q,因此,通过界面
离子和C+离子顺序地向阴极移动,可以观察到清晰界面的缓慢移动。若通过的电量为Q,则C+离子迁移的电量为t+Q,因此,通过界面![]() 的C+离子的物质的量为t+Q/F,即在界面ab和
的C+离子的物质的量为t+Q/F,即在界面ab和![]() 间的液柱中全部C+离子通过了界面
间的液柱中全部C+离子通过了界面![]() 。设此液柱的体积为V,溶液中C+离子的浓度为c,则
。设此液柱的体积为V,溶液中C+离子的浓度为c,则
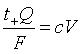
故
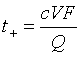 (10)
(10)
玻璃管的直径是已知的,界面移动的距离![]() 可由实验测得,这样V便可计算出来;Q可由电量计测出,故可由式(10)计算出t+。
可由实验测得,这样V便可计算出来;Q可由电量计测出,故可由式(10)计算出t+。
表2为298.15K时用界面移动法测得的阳离子在不同浓度时的迁移数。
表2 298.15K时在水溶液中一些阳离子的迁移数
电解质 |
c/( |
||||||
0.01 |
0.02 |
0.05 |
0.10 |
0.20 |
0.50 |
1.00 |
|
HCl |
0.825 |
0.827 |
0.829 |
0.831 |
0.834 |
|
|
LiCl |
0.329 |
0.326 |
0.321 |
0.317 |
0.311 |
0.300 |
0.287 |
NaCl |
0.392 |
0.390 |
0.388 |
0.385 |
0.382 |
|
|
KCl |
0.490 |
0.490 |
0.490 |
0.490 |
0.489 |
0.489 |
0.488 |
KBr |
0.483 |
0.483 |
0.483 |
0.483 |
0.484 |
|
|
KI |
0.488 |
0.488 |
0.488 |
0.488 |
0.489 |
|
|
KNO3 |
0.508 |
0.509 |
0.509 |
0.510 |
0.512 |
|
|
AgNO3 |
0.465 |
0.465 |
0.466 |
0.468 |
|
|
|
BaCl2 |
0.440 |
|
0.432 |
0.425 |
|
0.398 |
0.379 |
LaCl3 |
0.463 |
|
0.448 |
0.438 |
|
0.396 |
|
从表2可见,在其它条件确定的情况下,离子的迁移数受电解质浓度的影响。当电解质溶液的浓度较大时,异性离子间相互吸引力较大,阴、阳离子的迁移速率均较小,此时若阴、阳离子所带的电荷相同,则所受影响大致相同,迁移数的变化不大;若阴、阳离子所带的电荷不同,则电荷数大的离子的迁移数减小比较明显。
例2 用金属铂作电极电解HCl溶液,阴极区一定量的溶液中在通电前后含Cl-的质量分别为0.177克和0.163克,在串联的银库仑计中有0.2508克银析出,试求H+和Cl-的迁移数。
解 此题为希托夫法测量离子的迁移数的实例,该法直接测量的是某极区溶液中离子浓度的变化情况。现在已知阴极区的浓度测量分析数据,所以只要弄清在阴极上发生的反应及阴极区离子迁移的情况,就可以求出迁移数。至于先计算哪个离子的迁移数,结果都是相同的。
先计算H+。
在阴极上发生的反应是:H++e-=(1/2)H2(g),所以在阴极区由于发生电解,H+的浓度是下降的,另外由于通电时离子的定向迁移,H+是迁进阴极区的,所以通电前后阴极区中H+离子物质的量变化服从下列关系式:
n后=n前-n电+n迁
而 n前=(0.177/35.5)mol=4.986×10-3mol
n后=(0.163g/35.5)mol=4.592×10-3mol
n电=(0.2508/108)mol=2.322×10-3mol
所以 n迁=n后-n前+n电=1.928×10-3mol
故 ![]() =n迁/n电=1.928×10-3/(2.322×10-3)=0.83
=n迁/n电=1.928×10-3/(2.322×10-3)=0.83
![]() =1-
=1-![]() =0.17
=0.17
例3 在用界面移动法测迁移数的装置中装有浓度为0.01065mol/dm3的HCl溶液,后面用一定浓度的LiCl溶液跟随。用11.54mA电流通电22分钟,HCl界面移动了15cm。求H+的迁移数。已知迁移管的内径为1cm。
解 与希托夫法测迁移数不同,在界面移动法中电解质溶液的浓度并未改变,而是根据界面移动的距离来计算迁移数。迁移的H+的物质的量为![]() Q/F,相当于溶液的体积为(
Q/F,相当于溶液的体积为(![]() Q/F)×(1/c),这就等于界面扫过的体积V,即πr2l,因此
Q/F)×(1/c),这就等于界面扫过的体积V,即πr2l,因此
V=(![]() Q/F)×(1/c)=πr2l
Q/F)×(1/c)=πr2l
所以 ![]() = Fcπr2l/Q
= Fcπr2l/Q
= 96500×10.65×3.142×(0.005)2×0.15/[(11.54×10-3)×(22×60)]
= 0.795
