一、填空题
1、导体分为电子导体和离子导体,前者的导电能力随着温度升高而 ,后者的导电能力随着温度的升高而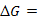 。
。
2、在电解质溶液中,离子B迁移数的定义式为:![]() 。离子B的电迁移率的定义式为:
。离子B的电迁移率的定义式为:![]() 。
。
3、法拉第电解定律表明,在电极上发生反应的物质的量,与![]() 成正比,与
成正比,与![]() 成反比。
成反比。
4、在室温下,Li+、Na+、K+极限摩尔电导率的大小关系是:![]()
![]() ,
,![]()
![]() 。
。
5、电解质溶液的摩尔电导率![]() 与电导率
与电导率![]() 之间的关系是: 。利用极限摩尔电导率
之间的关系是: 。利用极限摩尔电导率![]() 、
、![]() 和
和![]() 计算
计算![]() 为:
为:![]()
。
6、在稀溶液范围内,电解质溶液的电导率,随着浓度的增加而 ,摩尔电导率随着浓度的增加而 。
7、摩尔电导率的物理意义是,将内含 的电解质,全部放入 两平行电极之间,此时溶液的电导即为![]() 。
。
8、离子摩尔电导率最大的阳离子是 ,离子摩尔电导率最大的阴离子是 。
9、质量摩尔浓度为![]() 的CaCl2水溶液,其离子强度为
的CaCl2水溶液,其离子强度为![]() ,离子的平均质量摩尔浓度为
,离子的平均质量摩尔浓度为![]() 。
。
10、离子的平均活度![]() 与平均活度因子
与平均活度因子![]() 的关系为: 。而平均活度因子
的关系为: 。而平均活度因子![]() 与正、负离子活度因子
与正、负离子活度因子![]() 、
、![]() 的关系为: 。
的关系为: 。
二、判断题(对者写“√”,错者写“×”)
1、电解质溶液是电中性的,正、负离子所带总电量相等,所以正、负离子离子的迁移数也相等。
2、离子迁移数与离子迁移速率成正比,某正离予的运动速率一定时,其迁移数也一定。
3、电解质溶液中各离子迁移数之和为1。
4、无限稀电解质溶液的摩尔电导率可以看成是正、负离子无限稀摩尔电导率之和,这一规律只适用于强电解质。
5、根据科尔劳施经验式:![]() ,当浓度c趋于零时,
,当浓度c趋于零时,![]() 。所以
。所以![]() 就是纯溶剂(水)的摩尔电导率。
就是纯溶剂(水)的摩尔电导率。
6、同为0.01 mol·kg-1的NaCl和MgCl2水溶液,则![]() >
>![]() 。
。
7、298 K时的无限稀释水溶液中,![]() >
>![]() >
>![]() >
>![]() 。
。
8、用Pt 电极电解NaCl水溶液时,通过溶液的总电量等于Cl-向阳极迁移的电量。
9、离子的平均活度![]() 与平均质量摩尔浓度
与平均质量摩尔浓度![]() 的关系为:
的关系为:![]() 。
。
10、德拜一休克尔公式适用于强电解质的稀溶液。
三、单项选择题
1、按导体导电方式的不同而提出的第二类导体,下列哪一点对于它特点的描述是不正确的?
A、其电阻随温度的升高而增大 B、其电导随温度的升高而增大
C、其导电的原因是离子的存在 D、当电流通过时在电极上有化学反应发生
2、描述电极上通过的电量与已发生电极反应的物质的量之间关系的是
A、欧姆(Ohm)定律 B、离子独立移动定律
C、法拉第(Faraday)定律 D、能斯特(Nernst)定律
3、0.3 mol·kg-1Na3PO4水溶液的离子强度(单位是mol·kg-1)是
A、0.9 B、1.8 C、0.3 D、1.2
4、用同一电导池分别测定浓度为0.01 mol·dm-3和0.1 mol·dm-3的不同电解质溶液的电阻,其值分别为1000 Ω及500 Ω,则它们的摩尔电导率之比是
A、1:5 B、5:1 C、1:20 D、20:1
5、在25℃无限稀释的水溶液中,离子摩尔电导率最大的是
A、La3+ B、Mg2+ C、NH4+ D、H+
6、在25 ℃无限稀释的水溶液中,离子摩尔电导率最大的是:
A、CH3COO- B、Br- C、Cl- D、OH-
7、电解质溶液的摩尔电导率可以看作是正、负离子的摩尔电导率之和,这一规律只适用于
A、强电解质 B、强电解质的稀溶液
C、无限稀溶液 D、物质的量浓度为1 mol·dm-3的溶液
8、科尔劳乌施定律认为电解质的摩尔电导率与其浓度成线性关系:![]() , 这一规律只是适用:
, 这一规律只是适用:
A、弱电解质 B、强电解质的稀溶液
C、无限稀溶液 D、浓度为1mol·L-1的溶液
9、0.1 mol·kg-1的CaCl2水溶液,其平均活度因子![]() =0.219,则离子平均活度
=0.219,则离子平均活度![]() 为
为
A、3.476×10-4 B、3.476×10-2
C、6.964×10-2 D、1.385×10-2
10、![]() 水溶液中,平均活度因子与离子活度因子的关系为
水溶液中,平均活度因子与离子活度因子的关系为
A、![]() B、
B、![]()
C、![]() D、
D、![]()

