第八章 可逆电池
 知识点一:可逆电池的热力学
知识点一:可逆电池的热力学
化学电池是将氧化还原反应过程中的吉布斯自由能变转变成电能的装置。分为自发电池和电解池两大类。自发电池(也称化学电源)是在外电路接通情况下可以产生电流,也就是通过体系内化学变化产生电流的装置;而电解池则相反,是需要消耗外电源的电能才能发生化学变化的装置。研究可逆电池的电动势可知悉化学反应过程中的热力学性质。本章着重讨论可逆电池热力学的有关问题。
一、可逆电池及韦斯顿标准电池
1.可逆电池与不可逆电池
可逆电池也是一个热力学的概念。热力学意义上的可逆要求是:当电池在开路状态下或与一个电动势正好相等的外电源反向连接,电路中没有电流流过,电池内不发生任何净变化;当外电源的电动势减小一微量,伴随着有电流的流过,电池内发生微小的化学反应;反之如果外电源的电动势增大一微量,则电流反向流通,电池内的化学反应也正好逆转。简言之,电池在充放电时,物质、能量均可逆的电池称为可逆电池。反之则为不可逆电池。要构成可逆电池,其电极也必须是可逆电极。下面以图1所示的电池为例加以说明。
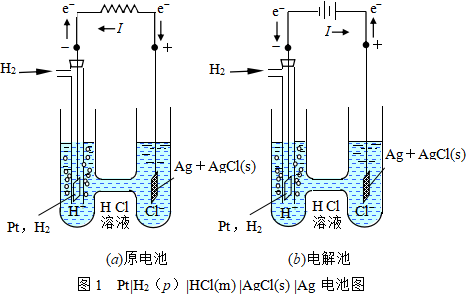
图1(a)所示的原电池可表示为Pt(s)|H2(p)|HCl(m)|AgCl(s)|Ag(s)。左侧的电极为氢电极。将镀有一层铂黑的铂片浸入盐酸溶液中,并不断地通纯净氢气于铂片上,就构成氢电极。右侧的电极为银—氯化银电极。银—氯化银电极是将表面有一层氯化银沉淀膜的银丝(或银片)浸入氯离子溶液中而构成的。
若用两根铜导线将所讨论的电池中之两极与电阻连接,则有电流沿图1(a)中所示的方向流动。电极反应为:
负极(氢电极) ![]() H2(p) → H+(
H2(p) → H+(![]() )+ e-
)+ e-
正极(银—氯化银电极) AgCl(s)+ e- → Ag(s) + Cl-( ![]() )
)
电池反应 ![]() H2(p)+ AgCl(s)→ Ag(s) + H+(
H2(p)+ AgCl(s)→ Ag(s) + H+(![]() )+ Cl-(
)+ Cl-(![]() )
)
将所讨论的电池连上另一电池(称它为外电池),使电池的负极与外电池的负极相接,正极与正极相接。若两电池的电动势恰好彼此抵消而不产生电流,则电池中不发生反应。在这种情况下,若将外电池的电动势减低无限小的量,则所讨论的电池中即发生上述的化学反应,产生无限小的电流通过外电池。反之,若将外电池的电动势增加无限小的量,则从外电池输出无限小的电流,通过所讨论的电池,如图1(b)所示。而所讨论的电池中发生的化学反应恰与上述反应相反,即
阴极(氢电极) H+(![]() )+ e- →
)+ e- → ![]() H2(p)
H2(p)
阳极(银—氯化银电极) Ag + Cl-(![]() ) → AgCl(s)+ e-
) → AgCl(s)+ e-
电池反应 Ag (s) + H+(![]() )+ Cl-(
)+ Cl-(![]() ) →
) → ![]() H2(p)+ AgCl(s)
H2(p)+ AgCl(s)
此时所讨论的电池变为电解池。显然,图1所讨论的电池即
Pt(s)|H2(p)|HCl(![]() )|AgCl(s)|Ag(s)
)|AgCl(s)|Ag(s)
满足可逆电池必须具备的条件,因而它是一个可逆电池。
2. 韦斯顿(Weston)标准电池
标准电池是作为电动势参考标准用的一种化学电池。是一种高度可逆的电池,它的电动势极其准确,重现性好,具有极小的温度系数,并且能长时间稳定不变。它的主要用途是配合电位差计测定另一电池的电动势。现在国际上通用的标准电池是韦斯顿电池,其一种结构如图2所示:
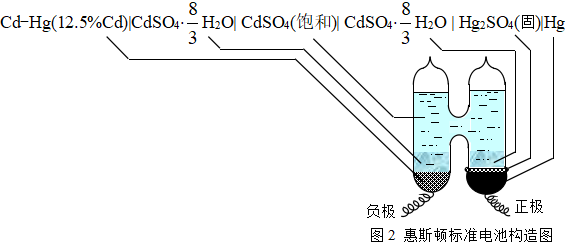
电池的负极是镉汞齐(约含Cd12.5%),正极由汞和固体硫酸亚汞的糊状体组成,在糊状体和镉汞齐上面均放有CdSO4·8/3H2O的晶体及其饱和溶液,即
Cd-Hg[w(Cd)=12.5%]|CdSO4·8/3H2O(s)|CdSO4饱和溶液|Hg2SO4(s)|Hg(s)
电池所进行的反应是:
负极 Cd(汞齐)→ Cd2+(![]() ) + 2e-
) + 2e-
Cd2+(![]() ) +
) + ![]() (
(![]() ) + 8/3H2O(l) → CdSO4·
) + 8/3H2O(l) → CdSO4·![]() (s)
(s)
正极 Hg2SO4(s)+ 2e- → 2Hg(l) + ![]() (
(![]() )
)
电池反应 Cd(汞齐)+ Hg2SO4(s)+ ![]() (l) → CdSO4·
(l) → CdSO4·![]() (s) + 2Hg(l)
(s) + 2Hg(l)
此电池在20℃时的电动势为![]() =1.018646V,在0-40℃间电动势
=1.018646V,在0-40℃间电动势![]() 与摄氏温度
与摄氏温度![]() 的关系为
的关系为
![]() =
=![]() -40.6×10-6(
-40.6×10-6(![]() -20)-0.95×10-6(
-20)-0.95×10-6(![]() -20)2-0.01×10-6(
-20)2-0.01×10-6(![]() -20)3
-20)3
实验室有时还用一种不饱和的韦斯顿电池(其电解液只是在4℃时饱和的CdSO4溶液),其特点是温度系数更小,一般情况下可忽略。标准电池不能持久通电,否则其平衡状态产生的破坏,便不能维持其电动势的标准值。
二、可逆电池的表示方法和电池电动势的测定
1. 可逆电池的表示方法
可用化学式和符号来简化描述电池的装置,例如铜—锌原电池也称丹尼尔电池(Daniell cell)可表示为:
Zn(s)|ZnSO4(1mol·kg-1)||CuSO4(1mol·kg-1)|Cu(s)
一般遵循以下规定:将发生氧化反应的负极写在左边,发生还原反应的正极写在右边;用单垂线“|”表示不同物相的界面(有时也用逗号表示)之间有接界电势存在。界面包括电极与溶液的界面,两种溶液间的界面或两种不同浓度的同一溶液间的界面;用双垂线“||”表示已加入盐桥使液接电势降至可忽略不计;要注明温度和压力(如不写明,常指298.15K和pƟ);要标明电极的物态,若是气体要注明压力和依附的活泼金属(有时也可忽略),所用的电解质要注明活度。因为这些因素都对电池电动势有影响。
例如:电池 Pt(s)|Fe2+(![]() ),Fe3+(
),Fe3+(![]() ) ||Cl-(
) ||Cl-(![]() ),Cl2(pƟ)|Pt(s)
),Cl2(pƟ)|Pt(s)
表示:
负极 Fe2+(![]() )→ Fe3+(
)→ Fe3+(![]() ) + e-
) + e-
正极 ![]() Cl2(pƟ)+ e- → Cl-(
Cl2(pƟ)+ e- → Cl-(![]() )
)
电池反应为两电极反应之和,故电池放电时的化学反应为
Fe2+(![]() )+
)+![]() Cl2(pƟ) → Fe3+(
Cl2(pƟ) → Fe3+(![]() )+ Cl-(
)+ Cl-(![]() )
)
在书写电极和电池反应时还必须注意遵守质量和电量平衡。
上面所述是双液电池的书写方法,是把两种电解质溶液放在不同的容器中,并用盐桥相连。盐桥起导电的作用,其机理后面详述。也可用膜或素烧瓷杯置于两种电解质溶液之间。如果两个电极插在同一电解质溶液中,则为单液电池,图1中将氢电极和银—氯化银电极都浸在电解质溶液盐酸中,即是单液电池的例子。
严格说来,由两个不同电解质溶液构成的具有液体接界的电池,都是热力学不可逆的。这是因为在液体接界处存在不可逆的扩散过程。例如丹尼尔电池,实际上不是可逆电池,但若不考虑溶液间离子扩散所产生的影响,则可将它近似地当作可逆电池。
2. 电动势的测定
物理学上讨论的电动势是两点之间推动电流流动趋势的一种衡量,其量纲与电压相同。而一般化学电池的电动势指的是在外电路断开时,电池两极间的电势差。由此定义知,电池电动势的测量应在相当于(或接近于)电池开路的情况下进行。一般采用电位差计或高阻抗的电子伏特计,而不能用普通的电压表。因为用电压表测量,总不免或多或少有电流流过电池,势必有一部分电动势消耗在极化和克服内阻上,因而测出的电压总小于电池的电动势。且电流通过电池时会发生化学反应使溶液的浓度不断变化,导致电动势不断改变,从而破坏电池的可逆性。
可逆电池电动势的测定必须在电流近于零的条件下进行。设![]() 为可逆电池电动势,
为可逆电池电动势,![]() 为两极间的电势差,即伏特表读数,
为两极间的电势差,即伏特表读数,![]() 为导线电阻(即外电阻),
为导线电阻(即外电阻),![]() 为电池内阻,
为电池内阻,![]() 为电流。则由欧姆定律:
为电流。则由欧姆定律:
![]() =(
=(![]() +
+![]() )
)![]()
若仅考虑外电路时,则![]() =
=![]()
![]()
两式中![]() 值相同,故
值相同,故 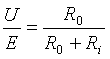
若![]() 很大,
很大,![]() 值与之相比可忽略不计,则
值与之相比可忽略不计,则![]() »
»![]() 。
。
波根多夫对消法就是根据上述原理测定电池电动势的方法。其线路如图3所示。
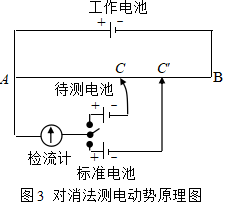
工作电池经AB构成一个通路,在均匀电阻AB上产生均匀电势降。待测电池的正极连接电键,经过检流计和工作电池的正极相连;负极连接到一个滑动接触点C上。这样,就在待测电池的外电路中加上了一个方向相反的电势差,它的大小由滑动接触点的位置决定。改变滑动接触点的位置,找到C点,若电键闭合时,检流计中无电流通过,则待测电池的电动势恰为AC段的电势差完全抵消。
为了求得AC段的电势差,可换用标准电池与电键相连。标准电池的电动势![]() 是已知的,而且保持恒定。用同样方法可以找出检流计中无电流通过的另一点
是已知的,而且保持恒定。用同样方法可以找出检流计中无电流通过的另一点![]() 。AC段的电势差等于
。AC段的电势差等于![]() 。因电势差与电阻线的长度成正比,故待测电池的电动势
。因电势差与电阻线的长度成正比,故待测电池的电动势
![]() =
=![]()
![]()
三、电池电动势与热力学函数的关系
可逆电池的电动势是原电池热力学的一个重要的物理量。从上节的讨论知,它是一个可以精确测定的量。通过测得不同温度下的可逆电动势,便可求得相应电池反应的热力学函数的变化值,非体积功以及过程热。
1.由可逆电动势计算电池反应的吉布斯自由能变化值
按式![]() ,在等温等压可逆过程中,系统吉布斯自由能的增量等于系统与环境间交换的可逆非体积功。当电池在等温等压可逆条件下放电时,系统对环境所作非体积功就是可逆电功,它等于可逆电动势与电量的乘积。因此,每摩尔电池反应所作的可逆电功
,在等温等压可逆过程中,系统吉布斯自由能的增量等于系统与环境间交换的可逆非体积功。当电池在等温等压可逆条件下放电时,系统对环境所作非体积功就是可逆电功,它等于可逆电动势与电量的乘积。因此,每摩尔电池反应所作的可逆电功![]() ,
,![]() 为可逆电动势,Z为电池反应转移的电荷数。
为可逆电动势,Z为电池反应转移的电荷数。
每摩尔电池反应的吉布斯自由能变化值为![]() ,则
,则
![]() (1)
(1)
例1 25℃时,丹尼尔电池
Zn(s)|ZnSO4(1mol·kg-1)||CuSO4(1mol·kg-1)|Cu(s)
的电动势![]() =1.100V,试计算该电池反应的
=1.100V,试计算该电池反应的![]() 。
。
解 该电池反应为
Zn(s) +CuSO4(1mol·kg-1)→ Cu(s) + ZnSO4(1mol·kg-1)
因为Cu2+和Zn2+都是二价带电离子,则进行每摩尔反应将有2F的电量通过电池。因此
![]() =(-2×96485×1.100)kJ·mol-1
=(-2×96485×1.100)kJ·mol-1
=-212.3kJ·mol-1
因为在等温等压不作非体积功的条件下,![]() ,反应可自发进行。因此从式(1)可知,只有当
,反应可自发进行。因此从式(1)可知,只有当![]() 时,电池反应才可以自发进行。若一个电池反应的
时,电池反应才可以自发进行。若一个电池反应的![]() ,则必须在电池上外加电压才能引起反应的发生。此时电池就成为电解池了。
,则必须在电池上外加电压才能引起反应的发生。此时电池就成为电解池了。
例2 熔盐电解生产铝的过程是采用碳电极电解冰晶石(Na3AlF6)中熔融的Al2O3溶液,电解反应可视为:
2Al2O3(熔融体)+ 3C(石墨) → 4Al(l)+ 3CO2(g)
假设电池可逆地工作,试计算在1300K产生Al时 必须加到电解池上的最低电压。已知1300 K时![]() (CO2(g))= -395kJ·mol-1,
(CO2(g))= -395kJ·mol-1,![]() (Al2O3(s))= -1260kJ·mol-1
(Al2O3(s))= -1260kJ·mol-1
Al2O3在冰晶石中的溶解度为12%。(实验上测得分解电势为1.70V)
解 已知1300 K时Al2O3在冰晶石中的溶解度为12%,则其摩尔分数
![]() (Al2O3)=(12/102)/[(12/102)+(88/210)]=0.219
(Al2O3)=(12/102)/[(12/102)+(88/210)]=0.219
现将Al2O3(s) → Al2O3(熔融体)设为理想溶液,则该过程吉布斯自由能变化为
![]() =-8.314J·K-1·mol-1×1300Kln0.219=16.4kJ·mol-1
=-8.314J·K-1·mol-1×1300Kln0.219=16.4kJ·mol-1
利用热力学数据计算![]() 并由此得到
并由此得到![]()
已知 C (石墨)+O2 (g) → CO2(g) ![]() = -395kJ·mol-1
= -395kJ·mol-1
2Al(l)+ ![]() O2 (g) → Al2O3(s)
O2 (g) → Al2O3(s) ![]() = -1260kJ·mol-1
= -1260kJ·mol-1
Al2O3(s)→ Al2O3(熔融体) ![]() =16.4kJ·mol-1
=16.4kJ·mol-1
因而反应 2 Al2O3(熔融体)+ 3 C(石墨) → 4 Al(l)+ 3 CO2
![]() =[-2×16.4-2×(-1260)+ 3×(-395)] kJ·mol-1 =1320 kJ·mol-1
=[-2×16.4-2×(-1260)+ 3×(-395)] kJ·mol-1 =1320 kJ·mol-1
![]() =-
=-![]() /12F=(-1.302×106/12×96485)V=-1.12V
/12F=(-1.302×106/12×96485)V=-1.12V
计算得到的分解电势为1.12 V,实验上测得分解电势为1.70 V。表明电池远离可逆电池,在阳极上O2的形成和碳的氧化是不可逆性的主要原因。
2. 由可逆电动势及温度系数计算电池反应的![]() 和
和![]()
将吉布斯—亥姆霍兹公式应用于关系式![]() 时,从可逆电动势的温度系数可计算出电池反应的
时,从可逆电动势的温度系数可计算出电池反应的
![]() 和
和![]() :
:
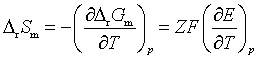 (2)
(2)
由于恒温时,![]() ,将式(1)和(2)代入可得:
,将式(1)和(2)代入可得:
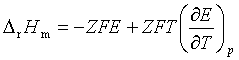 (3)
(3)
从实验测得![]() 和电动势的温度系数
和电动势的温度系数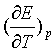 ,就可由式(3)计算反应的
,就可由式(3)计算反应的![]() 。
。![]() 在量值上等于该反应在没有非体积功的情况下进行时的等温等压反应热。由于能够非常精确地测定电动势,故用电动势法测出的一些反应热效应往往比量热法测得的数据更为精确一些。
在量值上等于该反应在没有非体积功的情况下进行时的等温等压反应热。由于能够非常精确地测定电动势,故用电动势法测出的一些反应热效应往往比量热法测得的数据更为精确一些。
在等温情况下,可逆反应的热效应为
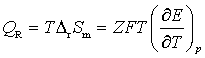 (4)
(4)
从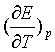 的数值为正或为负,可确定可逆电池在工作时是吸热还是放热。
的数值为正或为负,可确定可逆电池在工作时是吸热还是放热。
例3 25℃时,韦斯顿标准电池的电动势![]() =1.01832V,其电动势的温度系数为
=1.01832V,其电动势的温度系数为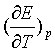 =-5.00×10-5 V·K-1。计算该电池反应的
=-5.00×10-5 V·K-1。计算该电池反应的![]() 、
、![]() 、
、![]() 及
及![]() 。
。
解 对于每摩尔的电池反应而言 Z=2,所以
![]() =-(2×96485×1.01832)kJ·mol-1=-196.5kJ·mol-1
=-(2×96485×1.01832)kJ·mol-1=-196.5kJ·mol-1
![]() =[2×96485×(-5.00×10-5)] J·K-1· mol-1=-9.65J·K-1· mol-1
=[2×96485×(-5.00×10-5)] J·K-1· mol-1=-9.65J·K-1· mol-1
![]() =
=![]() +
+![]() =[-196.5)+298×(-9.65×10-3)]J·K-1·mol-1
=[-196.5)+298×(-9.65×10-3)]J·K-1·mol-1
=-199.4 kJ·mol-1
![]() =
=![]() =[298×(-9.65)]J·mol-1=-2.88 kJ·mol-1
=[298×(-9.65)]J·mol-1=-2.88 kJ·mol-1
此例说明该反应一般情况下若在等温等压(如在烧瓶中)进行时![]() =
=![]() =-199.4 kJ·mol-1,即发生1 mol反应时系统向环境放热199.4 kJ;但同量的反应在原电池中等温等压可逆放电时仅放热2.88 kJ,少放出来的196.5 kJ的热量作了电功。因
=-199.4 kJ·mol-1,即发生1 mol反应时系统向环境放热199.4 kJ;但同量的反应在原电池中等温等压可逆放电时仅放热2.88 kJ,少放出来的196.5 kJ的热量作了电功。因![]() =
=![]() =-196.5kJ。由此可知,电池反应的可逆热,不是该反应的恒压反应热,因为通常所说的反应热要求过程无非体积功,电池可逆热是有非体积功的过程热。
=-196.5kJ。由此可知,电池反应的可逆热,不是该反应的恒压反应热,因为通常所说的反应热要求过程无非体积功,电池可逆热是有非体积功的过程热。
四、能斯特方程
能斯特方程是表达电极的平衡电势与电极反应各组分活度关系的方程式。因最早是由能斯特于1890年以浓度而不是活度提出了类似的表达式,为纪念他对电化学热力学的贡献而以他的名字命名。
对于任一个电极反应
![]()
若各组分的活度为aA、aB……,则相应于平衡状态时的电极电势为:
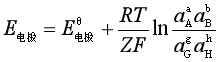
即  (5)
(5)
上式称为电极反应的能斯特方程。
![]() 为一常数,它表示当电极反应各组分的活度
为一常数,它表示当电极反应各组分的活度![]() A、
A、![]() B、
B、![]() G、
G、![]() H均为1时该反应的平衡电势,即电极的标准电极电势。(当然
H均为1时该反应的平衡电势,即电极的标准电极电势。(当然![]() 的值与所选用的标度有关。现在国际上统一采用氢标)
的值与所选用的标度有关。现在国际上统一采用氢标)
能斯特方程表示的是电极反应的热力学关系。不管反应的历程如何,只要该电极反应能达到平衡,该方程即适用。从能斯特方程还可得到由任意两个电极反应组成的可逆电池的电动势,即电池反应的能斯特方程。例如,单液电池
Pt(s)|H2(![]() )|HCl(
)|HCl(![]() )|Cl2(
)|Cl2(![]() )|Pt (s)
)|Pt (s)
产生两摩尔元电荷的电量,则
负极 H2(![]() ) → 2 H+(
) → 2 H+(![]() )+ 2e-
)+ 2e-
正极 Cl2(![]() )+ 2e- → 2Cl-(
)+ 2e- → 2Cl-(![]() )
)
电池反应 H2(![]() )+ Cl2(
)+ Cl2(![]() )→ 2 H+(
)→ 2 H+(![]() )+2Cl-(
)+2Cl-(![]() )
)
根据化学反应等温式,其![]() 为
为
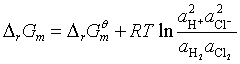 (6)
(6)
将(1)式代入得
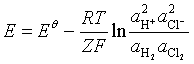 (7)
(7)
式中![]() 为所有参加反应的组分都处于标准态时的电动势,
为所有参加反应的组分都处于标准态时的电动势,![]() 为电极反应中的电子的计量系数,在本例中
为电极反应中的电子的计量系数,在本例中![]() =2。当涉及纯液体或固态纯物质时,其活度为1,当涉及气态时,
=2。当涉及纯液体或固态纯物质时,其活度为1,当涉及气态时,![]() ,f为气体的逸度,若气体可视为理想气体,则
,f为气体的逸度,若气体可视为理想气体,则![]() 。
。
若将电池反应写成一般式为
aA + bB → gG + hH
则 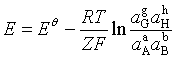
即 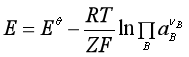 (8)
(8)
因为![]() 在给定温度下有定值,所以式(8)表明了电动势
在给定温度下有定值,所以式(8)表明了电动势![]() 与各参加电池反应的组分活度之间的关系,称为电池反应的能斯特方程。
与各参加电池反应的组分活度之间的关系,称为电池反应的能斯特方程。
25℃时,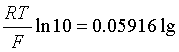
于是式(8)可表示成
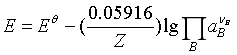 (9)
(9)
若电池反应中各参加反应的物质都处于标准态,则有
![]() =
=![]()
![]() (10)
(10)
而 ![]() (11)
(11)
合并(10)和(11)式得
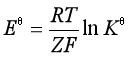 (12)
(12)
![]() 的值可以通过标准电极电势表(见附录) 得到,从而可由(12)式计算电池反应的标准平衡常数
的值可以通过标准电极电势表(见附录) 得到,从而可由(12)式计算电池反应的标准平衡常数![]() 。
。
