一、填空题
1、形成可逆电池,必须满足的两个条件是 可逆和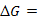 可逆。
可逆。
2、可逆电池的反应热![]() 。反应的摩尔焓变
。反应的摩尔焓变![]() 。
。
3、电极电势的定义(IUPAC规定)是,将 电极作为负极,……,组成原电池,则该原电池的 就是待测电极的电极电势。
4、电极![]() |
|![]() 属于第 类电极,电极
属于第 类电极,电极![]() |
|![]() |
|![]() 属于第
属于第
类电极。
5、液体接界电势产生的原因是 ,通过加入 可以降低。
6、盐桥的作用是 ,常用 饱和溶液。
7、电池反应的摩尔吉布斯自由能![]() 与电池电动势E间的关系是: 。标准电动势
与电池电动势E间的关系是: 。标准电动势![]() 与电池反应的标准平衡常数
与电池反应的标准平衡常数![]() 之间的关系是: 。
之间的关系是: 。
8、甘汞电极Cl-│Hg2Cl2(s)│Hg(l)的电极反应为: ,其电极电势的表达式(能斯特方程)写作: 。
9、测量难溶盐![]() 的溶度积,可以设计成电池: 。电池
的溶度积,可以设计成电池: 。电池![]() 的电池反应为: 。
的电池反应为: 。
10、利用电动势法测定溶液的pH,需要选择对氢离子可逆的电极。这类电极有:醌氢醌电极、 或 等。
二、判断题(对者写“√”,错者写“×”)
1、韦斯顿标准电池是作为电动势参考标准用的一种化学电池。
2、测量原电池的电动势不能用伏特计。
3、自发电池的电池反应一定是氧化还原反应,非氧化还原反应不能设计成电池。
4、燃料电池在等温等压下可逆工作时,放出的热量等于![]() 。
。
5、严格说来,由两个不同电解质溶液构成的具有液体接界的电池,都是热力学不可逆的。
6、浓差电池的标准电动势![]() 。
。
7、在25 ℃时,1 mol·kg-1甘汞电极的电极电势为0.2801 V,所以该温度时,甘汞电极标准电极电势![]() 。
。
8、由![]() 可知,
可知,![]() 是在标准状态下,反应达平衡时的吉布斯自由能的变化值,当反应平衡时,
是在标准状态下,反应达平衡时的吉布斯自由能的变化值,当反应平衡时,![]() ,所以
,所以![]() 。
。
9、电极Cl-│Cl2(g)的电极电势![]() 可用能斯特公式计算,但是当Cl2(g)为非理想气体时,则不能用能斯特公式计算。
可用能斯特公式计算,但是当Cl2(g)为非理想气体时,则不能用能斯特公式计算。
10、查表知,铜电极的标准电极电势![]() 。加入规定标准氢电极的电极电
。加入规定标准氢电极的电极电
势![]() ,那么
,那么![]() 。
。
三、单项选择题
1、下列电池中,电动势与Cl-离子的活度无关的是
A、Zn︱ZnCl2 (a)︱Cl2(pө)︱Pt
B、Zn︱ZnCl2 (a1)‖KCl (a2)︱AgCl(s)︱Ag
C、Ag︱AgCl︱KCl (a)︱Cl2(pө)︱Pt
D、Pt︱H2(pө)︱HCl (a)︱Cl2(pө)︱Pt
2、298.15 K时,某电池反应为Zn(s)+Mg2+(a=0.1)![]() Zn2+(a=1)+Mg(s),实验测得该电动势E=-0.2312V,则电池的
Zn2+(a=1)+Mg(s),实验测得该电动势E=-0.2312V,则电池的![]() 为
为
A、0.2903V B、-0.2312V
C、0.0231V D、-0.202V
3、298.15 K时,在下列电池的溶液中加入0.01mol·kg-1的Na2S溶液,则电池的电动势将
Pt︱H2(pө)︱H+(a=1)‖CuSO4(0.01mol·kg-1)︱Cu(s)
A、升高 B、下降
C、不变 D、无法判断
4、将反应H++OH-![]() H2O设计成可逆电池,下列电池中正确的是
H2O设计成可逆电池,下列电池中正确的是
A、Pt︱H2︱H+ (aq)‖OH-︱O2︱Pt
B、Pt︱H2︱NaOH (aq)︱O2︱Pt
C、Pt︱H2︱NaOH (aq)‖HCl (aq)︱H2︱Pt
D、Pt︱H2 (p1)︱H2O︱H2 (p2)︱Pt
5、应用能斯特方程计算出电池的E<0,则表示电池的反应
A、不可能进行
B、反应已达平衡
C、反应能进行,但方向和电池的书面表示式刚好相反
D、反应方向不能确定
6、298.15 K时,电池反应Ag+![]() Hg2Cl2
Hg2Cl2![]() AgCl+Hg的ΔrSm为32.9 J·K-1·mol-1,电池的E=0.0193 V,则其温度系数
AgCl+Hg的ΔrSm为32.9 J·K-1·mol-1,电池的E=0.0193 V,则其温度系数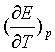 为
为
A、1.70×10-4V·K-1 B、3.4×10-4V·K-1
C、1.76×10-2V·K-1 D、1.1×10-6V·K-1
7、电池在恒温恒压及可逆条件下放电,则其与环境的热交换为
A、ΔrHm B、TΔrSm
C、一定为零 D、与ΔrHm、TΔrSm均无关
8、当某一反应的反应物和产物的活度都为1时,要使该反应能在电池内自发进行,则
A、E为负值 B、![]() 为正值
为正值
C、E为零 D、上述都不对
9、对于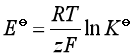 一式的正确理解是
一式的正确理解是
A、表示电池内各物质都处于标准态
B、表示电池反应已达平衡
C、表示电池内各物质都处于标准态且反应已达平衡
D、![]() 与
与![]() 仅在数值上满足上述关系,两者物理意义并不相同
仅在数值上满足上述关系,两者物理意义并不相同
10、已知298.15 K时,下列电极电势为![]() =-0.7628V,
=-0.7628V, ![]() =-0.4029V,
=-0.4029V, ![]() =0.5355V,
=0.5355V, ![]() =0.7991V,下列电池标准电动势最大的是
=0.7991V,下列电池标准电动势最大的是
A、Zn(s)︱Zn2+‖Cd2+︱Cd(s) B、Zn(s)︱Zn2+‖H+︱H2,Pt
C、Zn(s)︱Zn2+‖I-︱I2,Pt D、Zn(s)︱Zn2+‖Ag+︱Ag (s)

