当前位置:课程学习>>第八章 可逆电池>>课前准备>>本章导学
原电池是利用自发反应将化学转化为电能的装置。根据热力学原理可知,恒温恒压下1 mol反应进度时,化学反应对外能放出的热量Q为反应的摩尔焓变ΔrHm,如果利用这一热量通过热机对外做功或者发电,目前实际能达到的最高能量转换效率一般只有40%左右。但如果能将反应放在原电池中自发进行,则恒温恒压下电池对外所能做的最大功为可逆非体积功Wf,R,其值等于反应的吉布斯自由能变ΔrGm,即ΔrGm=Wf,R,(见第二章)。由此可知利用原电池将化学能转化为电能的理论上的能量转换效率η为
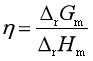
例如反应
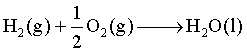
在25 ℃、100 kPa下反应的![]() ,
,![]() ,按上式计算的原电池的能量转换效率可高达83%。由此可见电池是一种可高效利用化学反应能量的装置,而且它不受理想热机效率的限制(即不受高、低温热源温度的限制)。不过恒温恒压下反应的ΔrGm是电池能将化学能转化为电能的理论上的最大值,由于电池内阻、电极极化等因素的影响,电池效率往往并不能达到其理论最大值。因此研究电池的性质,改进电池的设计,制造出高效率的化学电池,具有十分重要的意义。不仅如此,研究可逆电池为解决化学热力学问题提供了电化学的方法和手段。
,按上式计算的原电池的能量转换效率可高达83%。由此可见电池是一种可高效利用化学反应能量的装置,而且它不受理想热机效率的限制(即不受高、低温热源温度的限制)。不过恒温恒压下反应的ΔrGm是电池能将化学能转化为电能的理论上的最大值,由于电池内阻、电极极化等因素的影响,电池效率往往并不能达到其理论最大值。因此研究电池的性质,改进电池的设计,制造出高效率的化学电池,具有十分重要的意义。不仅如此,研究可逆电池为解决化学热力学问题提供了电化学的方法和手段。
物理化学中主要介绍电池在理想状态、也就是在可逆条件下的工作原理和基本热力学性质。


