同学们,本栏目是对你们学过的知识和生活中常见问题的归纳。其中,有一些共性问题,也许你会需要哦!
让我来帮你解决常见问题!
问题一:把化学能转变成电能的条件是什么?电化学中依能量来源不同把电池分为几种?
回答:
把化学能转变成电能的条件是:(1)该化学反应是氧化还原反应,或者是可以通过氧化还原的步骤来完成的反应,该化学反应在常温常压下能自发进行;(2)要有两个电极等装置,使该化学反应能够分别通过正负电极来完成。(3)要有与两个电子电极(导体)建立电化学平衡的电解质溶液。(4)要有其他必要的附属设备,组成一个完整的电路。
依能量来源不同把电池分为两种:化学电池与浓差电池,电池的能量来源于化学反应,称为化学电池,能量来源于物质从高浓度向低浓度扩散,称为浓差电池,化学电池与浓差电池都称原电池,简称为电池。
问题二:可逆电极有哪些主要类型?每种类型试举一例,并写出该电极的还原反应,对于气体电极和氧化还原电极在书写电极表示式时应注意什么问题?
回答:
可逆电极主要有以下三种类型。
(1)第一类电极,是金属电极与气体电极,金属电极由金属浸在含有该金属离子的溶液构成的。例如:Zn(s)插在ZnSO4溶液中,电极反应:![]() ;气体电极是气体吸附在Pt上,与含气体相关离子溶液组成,例如: Ptl H2 (g) | OH- ,电极反应:
;气体电极是气体吸附在Pt上,与含气体相关离子溶液组成,例如: Ptl H2 (g) | OH- ,电极反应:![]() 。
。
(2)第二类电极,金属—金属难溶盐及其阴离子组成,或金属—金属氧化物及其酸、碱性溶液组成。例如:银-氯化银电极Cl- (aq) |AgCl(s) | Ag(s)。
电极反应: ![]() ;银—氧化银电极Ag(s) |Ag2O(s) OH-,电极反应:
;银—氧化银电极Ag(s) |Ag2O(s) OH-,电极反应: ![]() 。
。
(3)第三类电极,氧化一还原电极,电子导体插在含有不同价态同种离子溶液中组成。例如: Fe3+(a1), Fe2+(a2) |Pt(s),电极反应:![]()
对气体电极和氧化还原电极来说,在书写电极表达式时应注意,气体要注明压力及吸附的不活泼金属,氧化还原电极注明电解质中两种离子的活度和其他影响电极电势大小的条件。
问题三:书面表示电池时有哪些规定?为什么电池电动势有正有负?用实验能测到负的电动势?
回答:
电池在书面上表示有以下规定:
(1)在左边的电极起氧化作用为负极,在右边的起还原作用为正极。
(2)用“|”或“,”表示物质的相界面,用“||”表示盐桥。
(3)要注明反应的温度、压力,不注明就是298.15 K,标准压力pƟ,要注明物态;气体要注明压力和吸附的惰性金属;溶液要注明浓度或活度。
电池电动势有正有负,是因为根据ΔrGm=-zEF,ΔrGm的值是可正可负的,故电池电动势有相应的正负,实验中使用电位差计测得可电池电动势E,读数总是正值,不能测出负的电动势。
问题四:如何把一个化学反应设计成可逆电池中的反应?
回答:
设计电池可按照下列步骤:(1)写出两个半电池反应(氧化、还原);(2)确定电极和电解质溶液;(3)写出电池表示符号;(4)最后作检验。
若反应是一个氧化—还原反应,把反应拆分成氧化、还原两个反应,再配上适当的电解质,氧化反应电极在左,还原反应电极在右,写出电池表示。若反应不是一个氧化还原反应,先根据反应的反应物与生成物种类,确定一个电极,写出该电极反应;用给出的反应式减去该电极反应式,可以得出另一个电极反应式,从而确定出另一个电极,可以写出电池表示。
问题五:联系电化学与热力学的主要桥梁是什么?并据此说明为什么要引入可逆电池的概念?
回答:
联系电化学与热力学的主要桥梁:![]() ,
,![]() 是热力学中化学反应自由能变化,E是电池电动势,因为热力学中
是热力学中化学反应自由能变化,E是电池电动势,因为热力学中![]() 、
、![]() 是通过可逆过程计算的,研究热力学需要的是可逆过程,用电化学研究热力学必须要引入可逆电池概念,可逆电池也是一个热力学概念概念。
是通过可逆过程计算的,研究热力学需要的是可逆过程,用电化学研究热力学必须要引入可逆电池概念,可逆电池也是一个热力学概念概念。
问题六:电池电动势E的物理意义是什么?它的大小与哪些因素有关?
回答:
电池电动势E的物理意义是指电流趋向零,两电极之间的最大电势差,在物理学中称为开路电压,它与电极的性质、参加反应的各物质的性质、浓度、温度、压力等因素有关。
问题七:可逆电池反应的热效应与一般化学反应的热效应是否为同一概念?可逆电池的反应热就是电池反应的热效应吗?
回答:
可逆电池反应的热效应与一般化学反应的热效应是同一概念,都是指等温等压或等温等容下,无非体积功时化学反应热![]() ;但是可逆电池的热与电池反应的热效应是不同概念,数值也不相等。可逆电池的反应热是
;但是可逆电池的热与电池反应的热效应是不同概念,数值也不相等。可逆电池的反应热是![]()
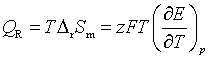
需要注意的是,有一些物理化学教材中把电池反应热也叫做电池反应热效应是不确切的,因为热力学中热效应是有不做非体积功的条件。
问题八: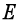 与
与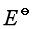 是强度性质的量还是容量性质的量?它们与什么因素有关?
是强度性质的量还是容量性质的量?它们与什么因素有关? 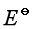 值必须是一个标准压力下,各物质的活度为1时的电动势吗?
值必须是一个标准压力下,各物质的活度为1时的电动势吗?
回答:
![]() 与
与![]() 都是强度性质的量,不是容量性质的量。
都是强度性质的量,不是容量性质的量。![]() 与
与![]() 与电池反应的物质数量无关,
与电池反应的物质数量无关,![]() 与温度、压力、各物质的活度有关,
与温度、压力、各物质的活度有关,![]() 只与温度有关。
只与温度有关。
![]() 称为标准电池电动势,是各反应物质都处于标准态下,认为“必须是一个标准压力下,各物质的活度为1时的电动势”,这句话不一定全对,若电池反应中不全是凝聚物质,或不只一种气体,因为各物质处于标准态,是各气体都是标准压力,若两种以上气体,“一个标准压力下”就不能满足各气体的压力都是标准压力,另外“各物质的活度为1”,还不是标准态,还要求活度因子都等于1,但有一种特殊情况,如果各物质的活度不一定是1,而各反应物质的活度商Q值刚巧等于1,由公式:
称为标准电池电动势,是各反应物质都处于标准态下,认为“必须是一个标准压力下,各物质的活度为1时的电动势”,这句话不一定全对,若电池反应中不全是凝聚物质,或不只一种气体,因为各物质处于标准态,是各气体都是标准压力,若两种以上气体,“一个标准压力下”就不能满足各气体的压力都是标准压力,另外“各物质的活度为1”,还不是标准态,还要求活度因子都等于1,但有一种特殊情况,如果各物质的活度不一定是1,而各反应物质的活度商Q值刚巧等于1,由公式:
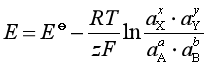
则该电池的电动势也等于该温度下的![]() 之值。
之值。
问题九:金属电极表面与电解质溶液之间的电势差和两种金属接触电势差的形成的原因有什么区别?
回答:
金属电极表面与电解质溶液之间的电势差是由于金属表面的离子溶解或吸附,造成金属电极表面上电荷密度与电极表面附近溶液电荷密度不同,从而产生电势差。而两种金属接触电势差是由于两种金属中的电子逸出功不同,自由电子在两种金属接触面处扩散,造成接触面两边电子密度不同而形成电势差。
问题十:电极电势是否就是电极表面与电解质溶液之间界面的电势差?单个电极的电板电势能否测量?电极的电极电势数值是如何确定的?用电极能斯特公式计算出电极的还原电势还是氧化电势?
回答:
电极电势不是电极表面与电解质溶液之间界面的电势差,它是人为规定值,选择标准氢电极为参考点的相对数值,也就是电极表面与电解质溶液之间界面的电势差与标准氢电极电势之间的差值。
单个电极的电极电势无法测量,因为实验只能测量两个电极组成的电池电动势。
把指定电极与标准氢电极组成电池,测量出该电池的电动势,由于已经定义标准氢电极的电势为零,那么测量出来的电池电动势就是该电极的电极电势,正负号是这样确定的,若在测量过程中,标准氢电极发生氧化反应(是负极),那么该电极的电极电势是高于标准氢电极的,取正值,若在测量过程中,标准氢电极发生还原反应(是正极),那么该电极的电极电势低于标准氢电极的,取负号,该规定是国际上大多数国家采用的还原电极电势。
因此用电极能斯特公式: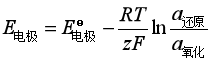 ,计算出电极的还原电势。
,计算出电极的还原电势。
问题十一:电极电势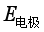 与标准电极电势
与标准电极电势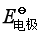 ,意义有何不同?它们与哪些因素有关?
,意义有何不同?它们与哪些因素有关?
回答:
电极电势![]() 是电极的相对电极电势,它是相对于标准氢电极的而得出的相对电极电势,它与电极本性、温度、压力、电解质中离子浓度等因素有关。
是电极的相对电极电势,它是相对于标准氢电极的而得出的相对电极电势,它与电极本性、温度、压力、电解质中离子浓度等因素有关。
标准电极电势![]() 是电极在标准状态下的电极电势,它也相对于标准氢电极的电势而得出相对值,它只与电极本性、温度有关,而与压力、电解质中离子浓度无关。
是电极在标准状态下的电极电势,它也相对于标准氢电极的电势而得出相对值,它只与电极本性、温度有关,而与压力、电解质中离子浓度无关。
问题十二:金属表面带正电还是带负电荷由什么因素所决定?在硫酸铜溶液插入铜电板时,金属铜表面带什么电荷?
回答:
金属表面带正电还是带负电荷主要由金属与金属离子的化学势(电化学势)来决定若正离子在溶液中的化学势高于它在金属表面上原子电化学势,离子自发在金属表面上析出,金属表面带正电荷、相反,若正离子在溶液中的化学势低于它在金属表面上原子电化学势,原子就会自发溶解到溶液中成为离子,金属表面带负电荷。
在硫酸铜溶液插入铜电极时,由于溶液中Cu2+化学势高于铜原子的化学势,Cu2+在金属Cu表面上析出,因此金属铜表面带正电荷。

